问题
计算题
某有机物A只含有一个氧原子。将0.1 mol A在足量氧气中完全燃烧产生3.6g水,产物还能与100 mL 2mol/L烧碱溶液恰好完全反应,将所得溶液在低温下蒸干,能得到16.8g纯净物。请计算:①A的分子式;②若A的核磁共振氢谱只有一个吸收峰,请写出A的结构简式。
答案
题目分析:n(H2O)=3.6g÷18g/mol=0.2 mol
因此根据氢原子守恒可知A中含有4个H
氢氧化钠的物质的量=0.1L×2mol/L=0.2mol
若纯净物是Na2CO3,则:
CO2 + 2NaOH=Na2CO3 + H2O
0.2mol 0.1mol
m(Na2CO3) 0.1mol×106g/mol=10.6g<16.8g
若纯净物是NaHCO3,则:
CO2 + NaOH = NaHCO3
0.2mol 0.2mol
m(NaHCO3) =0.2mol×84g/mol=16.8g
因此所得纯净物是NaHCO3
实验根据碳原子守恒可知n(CO2)=0.2mol
则有机物A中含有2个C
因此A的分子式为C2H4O
又因为A的核磁共振氢谱只有一个吸收峰
这说明A分子中氢原子只有一类
所以A的结构简式为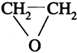 。
。
