(10分)维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:
C6H8O6+I2===C6H6O6+2HI
现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下:
取10 mL 6 mol·L-1CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中,加入1 mL指示剂,立即用浓度为0.05000 mol·L-1的I2溶液进行滴定到终点,消耗21.00 mL I2溶液。
(1)实验中的指示剂是_____________。
(2)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用。煮沸的目的是________________;冷却的目的是__________________。
(3)计算样品中维生素C的质量分数(要求列式,且式中各物理量带单位)。
(1)淀粉溶液 (2)除去溶液中溶解的O2,避免维生素C被O2氧化;减缓滴定过程中维生素C与液面上空气接触时被氧化的速率
(3)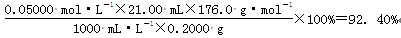
题目分析:(1)由于淀粉遇碘单质会变为蓝色,若没有I2蓝色就褪去。因此在该实验中的指示剂是淀粉溶液。(2)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用。煮沸的目的是除去溶液中溶解的O2,避免维生素C被O2氧化;冷却的目的是减缓滴定过程中维生素C与液面上空气接触时被氧化的速率。(3)因为在反应方程式中维生素C与I2反应的物质的量的比为1:1,n(I2)= 0.05000 mol/L×0.021L =1.05× 10—3mol.所以n(C6H8O6)= 1.05×10—3mol.m(C6H8O6)= 1.05×10—3mol×176g/mol=0.1848g.所以样品中维生素C的质量分数是(0.1848g ÷0.2000 g)×100%=92.40%.
