问题
问答题
如图所示,A、B为实验室制取某种气体的实验装置,
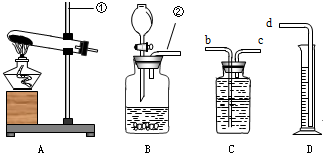
请回答下列问题:
(1)图中编号仪器的名称分别为:①______,②______;
(2)从反应物状态和反应条件来比较装置A和装置B的差异.
| 装置A | 装置B | |
| 反应物状态 | ______ | ______ |
| 反应条件 | ______ | ______ |
A→______,______→d.
(4)请根据化学方程式计算,2g 高锰酸钾完全分解理论上可生成标准状况下的氧气约多少升?(已知氧气在标准状况下的密度为1.429g/L).
答案
(1)依据对常见仪器的认识可知①是铁架台②是导气管.
故答案为:铁架台;导气管
(2)装置A,反应物的状态是固体,反应条件是加热;装置B,反应物的状态是液体,反应的条件是不需加热.
故答案为:
| 装置A | 装置B | |
| 应物状态和反应条件 | 固体 需加热 | 液体(或液体和固体), 不需加热 |
故答案为:c;b
(4)设加热2g高锰酸钾完全分解,可生成氧气的质量为x
2KMnO4
K2MnO4+MnO2+O2↑ 加热 .
2×158 32
2g x
=2×158 2g 32 x
解之得:x=0.2025g
标准状况下的氧气体积是:
=0.14L0.2025g 1.429g/L
答:可生成氧气的体积约为0.14L
