如图为实验室制取气体的装置图,请按要求回答相关的问题:
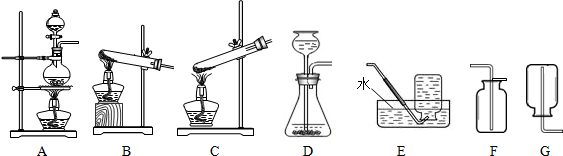
(1)小亮同学在检验装置D的气密性时,他首先在锥形瓶中加入水,水的量能封住长颈漏斗下端,然后通过导气管缓缓向锥形瓶中吹气.如果装置气密性良好,他应该观察到的现象有______.
A.长颈漏斗下端管口有气泡出现 B.锥形瓶中的液面明显上升
C.长颈漏斗内的液面下降 D.长颈漏斗内的液面上升
(2)在实验室制氧气时应选用的收集装置为______和______,原因是什么?
(3)实验室制取氯气的反应原理为:
MnO2(固体)+4HCl(液体)
MnCl2+2H2O+Cl2↑ △ .
根据氯气的制取原理,实验室制取氯气的发生装置应选用______.
(4)在实验室制氧气时,若取用32g高锰酸钾,加热一段时间后得到1.6g氧气,试计算所得固体中有多少克锰酸钾.
(1)检验装置D的气密性时,在锥形瓶中加入水封住长颈漏斗下端,通过导气管缓缓向锥形瓶中吹气.如果装置气密性良好,锥形瓶内气压增大,将水压入长颈漏斗内.因此观察到的现象是长颈漏斗内的液面上升.
(2)因为氧气的密度比空气大,可用向上排空气法收集,氧气不易溶于水,可用排水法收集;
(3)二氧化锰是固体,浓盐酸是液体,反应条件是加热,故发生装置选A.
(4)写出高锰酸钾分解的化学方程式式,根据生成的氧气的质量,可求出另一生成物锰酸钾的质量.
故答案为:(1)D (1分)
(2)E和F,因为氧气不易溶于水,密度比空气大.(4分)
(3)A(1分)
(4)设所得固体中锰酸钾质量为x.
2KMnO4
K2MnO4+MnO2+O2↑ …(1分) △ .
197 32
x 1.6g …(1分)
197:32=x:1.6g
x=197×1.6g/32=9.85g …(1分)
答:所得固体中锰酸钾质量为9.85g. …(1分)
