已知:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+2FeCl2===2FeCl3;
2KI+2FeCl3===2KCl+I2+2FeCl2。则下列判断错误的是
A.氧化性:MnO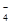 >Cl2>Fe3+ >I2
>Cl2>Fe3+ >I2
B.FeCl3既有氧化性又有还原性
C.向FeI2溶液中通入少量的Cl2,发生反应的方程式为6FeI2+3Cl2=2FeCl3+4FeI3
D.FeCl3能使湿润的淀粉碘化钾试纸变蓝
答案:C
题目分析:在氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,所以根据第一个反应可知氧化性:MnO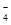 >Cl2,根据第二个反应可确定氧化性:Cl2>Fe3+;根据第三个反应可确定:Fe3+ >I2。所以氧化性由强到弱的顺序是MnO
>Cl2,根据第二个反应可确定氧化性:Cl2>Fe3+;根据第三个反应可确定:Fe3+ >I2。所以氧化性由强到弱的顺序是MnO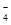 >Cl2>Fe3+ >I2。正确。B.在FeCl3中Fe的化合价为+3价,是该元素的最高化合价,表现氧化性,而Cl元素为其最低化合价,表现还原性,因此FeCl3既有氧化性又有还原性。正确;C.向FeI2溶液中通入少量的Cl2,发生反应的方程式为2I-+Cl2=2Cl-+I2,错误;D.FeCl3能把KI氧化为I2,所以使湿润的淀粉碘化钾试纸变蓝,正确。
>Cl2>Fe3+ >I2。正确。B.在FeCl3中Fe的化合价为+3价,是该元素的最高化合价,表现氧化性,而Cl元素为其最低化合价,表现还原性,因此FeCl3既有氧化性又有还原性。正确;C.向FeI2溶液中通入少量的Cl2,发生反应的方程式为2I-+Cl2=2Cl-+I2,错误;D.FeCl3能把KI氧化为I2,所以使湿润的淀粉碘化钾试纸变蓝,正确。