如图是实验室制取气体的常用装置.
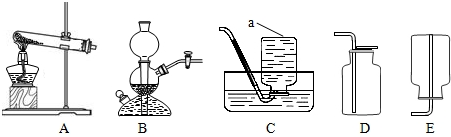
①写出仪器a的名称:a______.
②用氯酸钾和二氧化锰的混合物制取O2可选择的装置组合是______(只写一组).
③实验室用B装置可制CO2气体,反应的化学方程式为:______.B装置图示的是反应______(填“发生”或“停止”).用二氧化锰和双氧水混合制氧气时,
______(填“能”或“不能”)用B装置,理由是______.
④取相同质量的粉末碳酸钙和块状碳酸钙分别与相同质量的稀盐酸在烧杯中混合,绘制出烧杯内物质总质量随反应时间的变化情况,如图所示,则粉末碳酸钙和盐酸反应所对应的曲线是______(填“①”或“②”).
⑤50g过氧化氢溶液和3gMnO2充分反应后,剩余物质52.2g,则产生氧气的质量是______克.
Ⅰ、求参加反应的过氧化氢的物质的量?(写计算过程)
Ⅱ、求过氧化氢溶液溶质的质量分数?(写计算过程)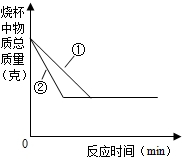
①仪器a名称为:集气瓶;
②氯酸钾和二氧化锰都是固体,反应条件是加热,发生装置选择A,氧气不易溶于水,密度比空气大,可用排水法或向上排空气法收集,故装置选择A,C或A,D;
③装置B适合块状固体和液体常温下反应,并可控制反应速度,可制取二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;B装置图示的反应发生;因为二氧化锰为粉末状固体,
用二氧化锰和双氧水混合制氧气时不能选用装置B;
④同质量的碳酸钙与相同质量的稀盐酸反应时,块状比粉末状固体和盐酸的接触面积小,反应速率慢;所以粉末状反应比较快,斜率大,所以粉末碳酸钙和盐酸反应所对应的曲线是②;
⑤根据质量守恒定律可知:产生氧气的质量=50g+3g-52.2g=0.8g;
Ⅰ、氧气的物质的量=0.8g÷32g/mol=0.025mol;
设生成0.025mol氧气需要过氧化氢的物质的量为x
2H2O2
2H2O+O2↑MnO2 .
2 1
x 0.025mol
=2 x 1 0.025mol
x=0.05mol;
Ⅱ、H2O2质量为:0.05×34=1.7(g)
H2O2质量分数=
×100%=3.4%.1.7 50
故答案为:①集气瓶;
②A,C(或A,D);
③CaCO3+2HCl═CaCl2+H2O+CO2↑;发生,不能,二氧化锰是粉末状固体;
④②;
⑤0.8克;
氧气的物质的量=0.8g÷32g/mol=0.025mol;
设生成0.025mol氧气需要过氧化氢的物质的量为x
2H2O2
2H2O+O2↑MnO2 .
2 1
x 0.025mol
=2 x 1 0.025mol
x=0.05mol;
Ⅱ、H2O2质量为:0.05×34=1.7(g)
H2O2质量分数=
×100%=3.4%.1.7 50
