(8分)某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2气体。请你参与下列的探究并回答问题。
[提出问题]上述酸和碳酸盐的反应是否适合在实验室制取CO2气体。
[方案设计]大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2气体,原因是浓盐酸挥发出的HCl气体混于CO2中,使制得的气体不纯。小明设计了下图装置来除去CO2中HCl,

洗气瓶中盛装的液体可以是 (填序号)
①浓硫酸 ②碳酸氢钠溶液
③氢氧化钠溶液 ④澄清石灰水
[实验与结论]
该小组设计了三个实验进行对比
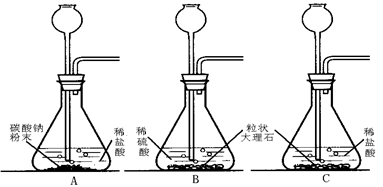
(1)请你填写实验C的实验现象和实验结论
| 实验 | 实验现象 | 实验结论 |
| A | 剧烈反应,迅速放出大量气体 | 反应速度过快,气体不便收集,不宜用于实验室制取CO2 |
| B | 产生气泡,速度迅速减慢,几秒钟后反应几乎停止 | 无法持续产生气体,不能用于实验室制取CO2 |
| C |
[拓展迁移]
将上述实验C反应后的混合物过滤。对滤液中的溶质,小聪同学提出了以下三种猜想:
①溶质是HCl;②溶质是CaCl2;③溶质是HCl和CaCl2
该小组成员一起讨论后认为,上述三种猜想中有一种是不合理的,你认为不合理的猜想是 (填序号)。对小聪的另外两种合理猜想,请你设计实验,并根据不同现象说明溶液中的溶质属于哪一种猜想。
②(1分)
(1)(各1分)
| 产生气泡,反应速率均匀、适中,持续放出气体 | 产生气体的速率均匀、适中,便于收集气体,适合实验室制取CO2 |
①(1分)
取滤液少许于试管中,向其中滴加几滴紫色石蕊试液,若不出现红色,则说明是猜想②;若出现红色,则说明是猜想③(2分,合理都给分)
分析:根据气体除杂的原则,既能除掉杂气又不能引人新杂质选择洗气液;实验室制取二氧化碳气体的反应原理进行分析解答本题.
解答:解:【方案设计】除去CO2中HCl,洗气瓶中盛装的液体既要吸收盐酸又不能与二氧化碳反应,题中浓硫酸不能吸收盐酸,氢氧化钠和石灰水都与二氧化碳反应,只有碳酸氢钠适合,故选②;
【实验与结论】
(1)实验A:碳酸钠粉末易溶于水,与盐酸接触面积大,剧烈反应,迅速放出大量气体,不利于气体收集;
实验B:粒状大理石与稀硫酸反应,生成硫酸钙微溶于水,附着在大理石表面,产生气泡,速度迅速减慢,几秒钟后反应几乎停止,无法持续产生气体;
实验C:粒状大理石与稀盐酸反应产生气泡,反应速率均匀、适中,持续放出气体,便于气体的收集,适合实验室制取CO2;
(2)制取二氧化碳的反应原理为:CaCO3+2HCl═CaCl2+H2O+CO2↑
【拓展与迁移】实验室制取CO2的化学反应原理可知,实验C反应后的混合物过滤,对滤液中的溶质可能为溶质是CaCl2或HCl和CaCl2,不可能只有HCl;要验证猜想可利用两种猜想中溶质性质的不同来设计实验,如氯化钙溶液为中性,溶质为含有HCl和CaCl2的溶液为酸性,可滴加紫色石蕊试液来验证.
故答案为:
【方案设计】②;
【实验与结论】
(1)
| 产生气泡,反应速率均匀、适中,持续放出气体 | 产生气体的速率均匀、适中,便于收集气体,适合实验室制取CO2 |
①(1分)取滤液少许于试管中,向其中滴加几滴紫色石蕊试液,若不出现红色,则说明是猜想②;若出现红色,则说明是猜想③(合理都给分).
