为了调节学校花圃中土壤的酸碱度,需要施加熟石灰。课外活动小组对学校库存的熟石灰准备进行实验,确定其是否变质以及变质的程度。同学们经过讨论认为该样品存在三种可能情况:没有变质;部分变质;完全变质。
| 实验步骤及操作 | 可能出现的实验现象 | 实验结论 |
| 取试样于试管中,加入足量的蒸馏水并振荡 ①吸取上层清液于pH试纸上 ②倒去上层清液,再向试管中注入稀盐酸 | ①pH>7 ② | 部分变质 |
| ①pH=7 ② | ||
| ① ②没有气体产生 |
(1) ;(2)
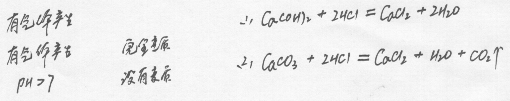
分析:熟石灰是氢氧化钙的俗称,能与空气中二氧化碳反应生成不溶于水的碳酸钙;利用氢氧化钙溶于水所得溶液呈碱性而碳酸钙不溶于水,通过测定溶液的酸碱度可检验氢氧化钙是否存在,通过滴加的稀盐酸能与固体碳酸钙反应放出二氧化碳而与氢氧化钙反应无气体产生,观察是否有气体检验碳酸钙是否存在.
解答:解:为检验熟石灰氢氧化钙变质情况,即检验氢氧化钙中是否含有碳酸钙,取样品溶解后测定上层清液的酸碱度,检验氢氧化钙是否存在;向未溶解的固体中滴加稀盐酸,观察是否有气体放出检验碳酸钙是否存在;若部分变质会出现上层清液的pH>7且观察到有气体放出,若完全变质则会出现上层清液的pH=7而有气体产生,若没有变质则会出现pH>7而无气体产生;
(1)氢氧化钙与滴加的稀盐酸反应,生成氯化钙和水,不产生气体,反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(2)变质形成的碳酸钙与滴加的稀盐酸反应,生成氯化钙、水和二氧化碳,有气体产生,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
故答案为:
| 实验步骤及操作 | 可能出现的实验现象 | 实验结论 |
| ②有气体产生 | ||
| ①pH=7②有气体产生 | 完全变质 | |
| ①pH>7 | 没有变质 |
(2)CaCO3+2HCl═CaCl2+H2O+CO2↑
