(12分)
(1)下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
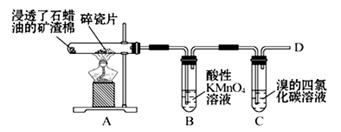
①A中碎瓷片的作用是 。
②B中反应类型是 。C中实验现象是 。(2)制取氯乙烷(CH3CH2Cl)的最佳方法是(用化学方程式表示): ;(3)用空气吹溴水到SO2溶液中的化学方程式: ;(4)把干海带放在 (仪器的名称)中灼烧。灼烧后的海带溶于水中,过滤后的滤液中酸化后加过氧化氢的离子方程式
(5)在试管A中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸,按下图所示连接好装置制取乙酸乙酯。
①试管B中盛放饱和Na2CO3溶液的作用是:中和乙酸、溶解乙醇和 。
②实验完成后,若要分离B中的液体混合物,需要用到的玻璃仪器主要是 。
(1)①催化作用;②氧化反应;溴的四氯化碳褪色;
(2)CH2===CH2+ HCl CH3CH2Cl(3)Br2+SO2+2H2O=H2SO4+2HBr
CH3CH2Cl(3)Br2+SO2+2H2O=H2SO4+2HBr
(4) 坩埚;H2O2+2I-+2H+=I2+2H2O
(5)①降低乙酸乙酯的溶解度 ②分液漏斗
(1)①碎瓷片能加快反应速率,起催化剂作用。
②乙烯含有碳碳双键能被酸性高锰酸钾溶液氧化。也能和溴水发生加成反应,使溴水褪色。
(2)制取氯乙烷(CH3CH2Cl)的最佳方法是乙烯和氯化氢的加成反应,方程式为CH2===CH2+ HCl CH3CH2Cl。
CH3CH2Cl。
(3)溴水具有氧化性,能氧化SO2,生成硫酸,方程式为Br2+SO2+2H2O=H2SO4+2HBr。
(4)固体加热需要用坩埚。双氧水具有氧化性,能氧化碘离子,方程式为H2O2+2I-+2H+=I2+2H2O。
(5)①饱和碳酸钠溶液还能降低降低乙酸乙酯的溶解度。
②乙酸乙酯不溶于水,分液即可,主要玻璃仪器是分液漏斗。
