某研究性学习小组对“H2S的水溶液是否显酸性”进行探究。请你参与他们的探究活动,并回答有关问题。
(1)查阅资料:①H2S是一种无色、有臭鸡蛋气味的有毒气体,能溶于水,在常温常压下,1体积水中能溶解2.6体积硫化氢;密度比空气的大;②实验室里,通常用硫化亚铁(FeS)固体跟稀盐酸或稀硫酸反应制取硫化氢。
(2)提出假设:H2S的水溶液显酸性
(3)实验探究:
Ⅰ.制备H2S
①若用稀盐酸制备H2S,其化学方程式为 。
②制取H2S的发生装置为 (填字母),收集装置只能选D的原因是 。
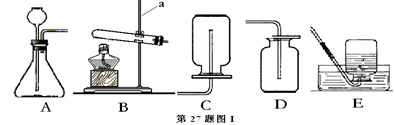
Ⅱ.设计如第27题图II所示装置进行验证实验。

①实验过程中,A装置内蓝色石蕊试纸的颜色始终没有变化。A装置的作用是 。
②在通入H2S之前将B装置中胶头滴管内的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,此操作的目的是 。当有H2S通过时发现湿润的蓝色石蕊试纸变红,此现象说明 。
(4)结论:原假设成立。
(5)反思与评价:该验证实验中,有一个明显疏漏,请你指出疏漏之处为 。
(6)知识拓展:H2S的水溶液显酸性,具有酸的通性,若用氢氧化钠溶液吸收尾气,则反应的化学方程式为 。
Ⅰ ①FeS + 2HCl = FeCl2 + H2S↑
② A H2S溶于水且密度比空气大(缺一不给分)
Ⅱ ①证明H2S气体不能使蓝色石蕊试纸变色(或干燥的H2S不显酸性)
②证明水不能使蓝色石蕊试纸变色(或证明水无酸性) 硫化氢的水溶液显酸性
(5)没有尾气处理(或吸收)装置 (6)2NaOH + H2S = Na2S + 2H2O
分析:I.根据反应物和生成物书写化学方程式,根据反应物的状态和生成物气体的溶解性和密度判断制取装置.
II.本题探究了H2S的性质和变化规律,本题设计的实验步骤是①先把干燥的H2S通入干燥的蓝色石蕊试纸上,现象是不变色;②B装置中胶头滴管内的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化;再通入H2S气体,蓝色石蕊试纸变红色,由此得出结论,H2S溶于水呈酸性.还要注意H2S有毒,会污染空气;根据酸碱中和反应生成盐和水的过滤书写化学方程式.
解:I.①若用稀盐酸制备H2S,硫化亚铁(FeS)固体跟稀盐酸反应生成氯化亚铁和硫化氢,其化学方程式为 FeS+2HCl═FeCl2+H2S↑;
②制取H2S的反应物为固体和液体反应不需要加热,故发生装置为 A,因为 H2S溶于水且密度比空气大,收集装置只能选向上排空气法;
II、(1)A装置内蓝色石蕊试纸的颜色始终没有变化,说明干燥的H2S不能使蓝石蕊试纸变色.
(2)在通入H2S之前将B装置中胶头滴管内的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,说明水不能使其变色.当有H2S通过时发现润湿的蓝色石蕊试纸变红,说明H2S溶于水呈酸性.
(4)查阅资料可知:H2S有毒,会污染空气,因此对尾气要进行处理.
(5)H2S的水溶液显酸性,具有酸的通性,若用氢氧化钠溶液吸收尾气会生成盐和水,反应的化学方程式为 2NaOH+H2S=Na2S+2H2O.
故答案为:
I ①FeS+2HCl=FeCl2+H2S↑ ②A H2S溶于水且密度比空气大(缺一不给分)
II (1)证明H2S气体不能使蓝色石蕊试纸变色(或干燥的H2S不显酸性)
(2)证明水不能使蓝色石蕊试纸变色(或证明水无酸性) 硫化氢的水溶液显酸性
(4)没有尾气处理(或吸收)装置
(5)2NaOH+H2S=Na2S+2H2O
点评:本考点探究了硫化氢溶于水呈酸性,属于实验探究题,既有实验过程的探究,又有结论的探究.首先提出问题、查阅资料,然后设计实验方案、进行实验,最后得出正确的结论,这是探究题的一般步骤和思路.
