(7分)某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.
[实验一] 选择合适浓度的硫酸
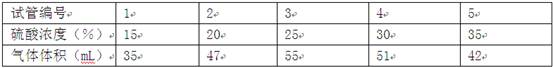
操作:在28℃时,用装有5mL硫酸溶液的注射器向盛有lg直径为2mm大理石的大试管中注入硫酸,记录15分钟内生成气体的体积,见下表:
[实验二] 选择合适的反应温度
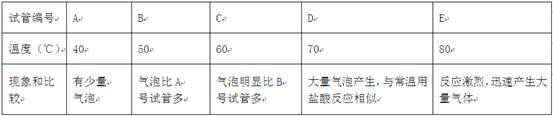
操作:往盛有lg直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
请根据本次活动的研究目的,分析处理以上两个表中数据,得出结论:
(1)稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为 ▲ %,因为浓度小于或大于合适浓度对反应的影响是 ▲ .
(2)在合适的硫酸浓度下,应选择最合适的反应温度为 ▲ ℃,因为温度高于或低于该温度对反应的影响是 ▲ .
(3)除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加 ▲ 操作,更有利于气体的制备.
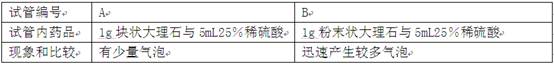
(4)该研究小组为了研究 ▲ 对该反应速率的影响,进行了如下实验.
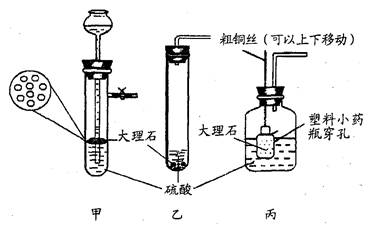
(5)根据上述实验研究,你觉得在以下硫酸和大理石反应的装置中,最佳选用 ▲ (填
编号) .
(1)25;生成气体体积较少。
(2)70;温度过低反应过慢,温度过高反应剧烈,不利于收集气体;
(3)摇动试管(或摇动装置)
(4)碳酸钙固体颗粒大小(其它合理回答也给分)
(5)丙
分析:(1)观察实验一图表,并对比即可得出正确答案;
(2)观察实验二图表,并对比即可得出正确答案;根据反应物和生成物写出化学反应式;
(3)为防止硫酸钙覆盖在大理石上,可以用摇动试管的方法解决;
(4)碳酸钙固体颗粒大小也会影响反应的速率;
(5)对比甲、乙、丙三个图示,看哪一个更合理,即选那个.
解:(1)观察实验一图表,3号试管收集的气体最多,此时管中硫酸浓度是25%.浓度大于或小于此浓度值生成的气体体积都少.故答案为:25、生成气体体积较少;
(2)观察实验二图表,可知应选择最合适的反应温度为70℃;低于70℃时,生成的气体少并且反应慢,高于70℃反应速率过快,不易收集.硫酸与大理石反应生成硫酸钙、水、二氧化碳,化学反应式是:CaCO3+H2SO4═CaSO4+CO2↑+H2O.
故答案为:70、温度过低反应过慢,温度过高反应剧烈,不利于收集气体、CaCO3+H2SO4═CaSO4+CO2↑+H2O;
(3)为防止硫酸钙覆盖在大理石上,可以用摇动试管的方法除去覆盖在大理石上的硫酸钙.
故答案为:摇动试管(或摇动装置);
(4)碳酸钙固体颗粒大小也会影响反应的速率,也可作为研究课题;
故答案为:碳酸钙固体颗粒大小(其它合理回答也给分,例如“大理石纯度”等);
(5)观察图示可知,丙装置可使反应随时停止,随时反应,其他装置没有此功能.
故答案为:丙.
点评:本题以实验探究的形式考查稀硫酸与大理石反应的适宜温度和浓度等问题,培养学生的对比能力、提取信息的能力
