【10湖北十堰21】.小丹同学在学习酸的性质时,从同一卷镁带中剪取长度相等的两根镁带,分别与室温下H浓度相同的稀盐酸、稀硫酸反应。观察发现:镁带在稀盐中放出气泡的速率明显快鱼在稀硫酸中防除气泡的速率。
[查阅资料]
1.金属与酸发生置换反映,基本质是金属单质与H反映。
2.生成H2速率主要取决与:①金属表面积 ②溶液中H浓度 ③温度等条件
3.H的浓度与1L溶液中H的数目成正比。
4.溶液中除H外的其它离子可能会影响反映速率。
[提出问题]
①小丹同学在进行上述实验时,控制了镁带与酸反映的哪几个条件?(答出两条)
②上述反映中C1-、SO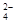 如果反映速度?
如果反映速度?
[猜想假设]
I.Cl-促进了镁与酸的反映,SO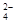 对反映无影响。
对反映无影响。
II.SO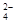 抑制了镁与酸的反映,C1-对反映无影响。
抑制了镁与酸的反映,C1-对反映无影响。
III. 。
请回答问题①,完成猜想3
[实验探究]为了验证猜想,小丹设计了如下实验:
| 实验 编号 | 铝片 长度 | H+浓度 相同的酸 | 反应片刻后 添加少量试剂 | 产生气泡 的速率 | 结论 |
| A | 2cm | 5mL盐酸 | Na2SO4固体 | 无明显变化 | (结论A) |
| B | 2cm | 5mL硫酸 | (试剂B) | 明显加快 | Cl-对反应有促进作用 |
试剂B是 (化学式)固体。
[结论]结论A为 。
[反思]将试剂B改用HC1气体,不能达到探究目的,其原因是 。
问题①:镁带的表面积;H+浓度,温度
猜想III:SO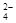 抑制了镁与酸的反应,Cl-促进了镁与酸的反应。
抑制了镁与酸的反应,Cl-促进了镁与酸的反应。
试剂B:NaCl
结论A:Na+、SO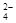 对反应无影响(漏Na+不扣水)
对反应无影响(漏Na+不扣水)
反 思:由于HCl气体溶于水生成了盐酸,增加了H+浓度,改变了实验条件。
分析:通过文字叙述可以看出控制反应速度,就必须控制:①金属的表面积 ②溶液中H+浓度 ③温度等条件.
假设探究时可组合各种情况解决假设方案,实验A、B是分别对硫酸根与氯离子的作用进行对比实验,分别得到要求的结论.
解答:解:①通过题目内容可以看出控制反应速度提供了三种方式::①金属的表面积 ②溶液中H+浓度 ③温度等条件.
故答案为:金属的表面积、溶液中H+浓度
三、III.结合观察发现:镁带在稀盐酸中放出气泡的速率明显快于在稀硫酸中放出气泡的速率,以及由各种情况进行不同的组合,只能是硫酸根抑制了反应速度,氯离子加速了反应的进行可能是该猜想III.
故答案为:硫酸根抑制了镁与酸的反应,氯离子加速了镁与酸的反应
四~五、A.实验是验证硫酸根对反应的影响,通过现象可得结论B实验是验证氯离子的影响,故加入的物质应含有氯离子,但又不能引入新的离子,故只能是加入氯化钠,加氯化氢气体时使溶液中氢离子增加,改变了实验条件,不可取.
故答案为:
四、NaCl;
五、钠离子、硫酸根离子对反应无影响;
六、通入HCl气体时,形成盐酸增加了氢离子的浓度,改变了实验的条件
