(9分)过氧化氢常用于消毒、漂白、化学制氧等方面,请回答下列问题:
(1)实验室制氧气:H2O2溶液在MnO2的作用下,可迅速分解放出O2,装置如右图.
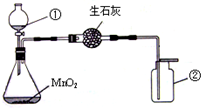
a、图中仪器的名称是① ▲ ;② ▲ ;
b、锥形瓶内装有MnO2和H2O2溶液,其中二氧化锰起 ▲ 作用;
c、实验中使用了68g 5%的H2O2溶液,需要将市售30%(密度约为1.0g/mL)的H2O2溶液 ▲ mL(精确到0.1)进行稀释,量取水时,应选择量程为 ▲ (10、50、100)mL的量筒,实验中生成O2的质量为 ▲ (不考虑装置内残留气体);
d、实验中,生石灰的作用是 ▲ ;
e、证明氧气已收集满的方法是 ▲ ;
(2)H2O2显弱酸性,有很强的氧化性,能使有机色质(如石蕊)褪色,若将5%H2O2溶液滴入紫色石蕊试液中,可能观察到的现象是 ▲ .
(1)a、①分液漏斗;②集气瓶 b、催化 c、11.3 100 1.6g
d、除去氧气中混有的水蒸气
e、将带火星的木条放在集气瓶口,若带火星的木条复燃,则满。
(2)紫色石蕊试液先变红,后逐渐褪色(合理答案也可得分)
解:(1)a、根据常用仪器的名称和用途可知仪器分别是:分液漏斗、集气瓶;
故答案为:①分液漏斗;②集气瓶;
b、二氧化锰是过氧化氢分解反应的催化剂;
故答案为:催化;
c、溶液稀释前后溶质的质量不变,溶质的质量=溶液的质量×溶质的质量分数可知:所用的过氧化氢溶液中溶质的质量是68g×5%=3.4g,溶液的质量=密度×体积可知:需要30%(密度约为1.0g/mL)的H2O2溶液的体积是:3.4g÷30%÷1.0g/mL=11.3mL;实验中需要水的质量为68g-3.4g=64.6g,由于水的密度是1g/mL,故水的体积是64.6mL,需100mL的量筒;
设68g 5%的H2O2溶液分解生成氧气的质量是X
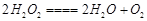
68 32
3.4g x
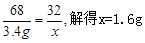
故答案为:11.3; 100; 1.6g;
d、生石灰可与水反应,吸收水分;
故答案为:除去氧气中混有的水蒸气;
e、氧气能助燃,所以验满方法是将带火星的木条放在集气瓶口,若带火星的木条复燃,则满;
故答案为:将带火星的木条放在集气瓶口,若带火星的木条复燃,则满;
(2)石蕊遇酸变红,所以紫色石蕊试液先变红,由题意知过氧化氢有很强的氧化性,能使有机色质(如石蕊)褪色,所以红色会逐渐消失;
故答案为:紫色石蕊试液先变红,后逐渐褪色(合理答案也可得分)
