(11分)食盐是日常生活中的必须品,也是重要的化工原料。一同学用某种粗盐进行提纯实验,步骤如图所示。
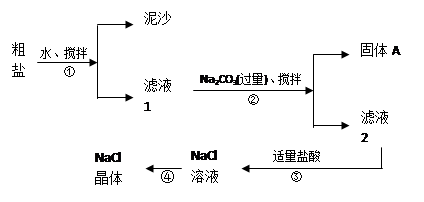
请回答:
Ⅰ.步骤①和②的操作名称是 (7) ;
Ⅱ.步骤④操作时要用玻璃棒不断搅拌,这是为了防止 (8) 。
Ⅲ.猜想与验证:
| 猜想 | 验证方法 | 实验现象 | 结论 |
| 猜想1: 固体A中含CaCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口。 | (9) | 猜想1成立 |
| 猜想2: 固体A中含BaCO3 | 取少量固体A于试管中,先滴入 (10) ,再滴入 (11) 溶液。 | 有气泡放出,无白色沉淀 | (12) |
| 猜想3: 最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中,加适量蒸馏水溶解,再 (13) 。 | (14) | 猜想3成立 |
(16) 。
(7)过滤 ;
(8)溶液局部过热而飞溅 ;
(9)产生气泡,烧杯内壁有白色固体生成(2分);
(10)稀盐酸或硝酸;
(11)Na2SO4;
(12)猜想2不成立;
(13)加酸化的BaCl2或Ba(NO3)2溶液;
(14)有白色沉淀生成;
(15)焰色反应实验有黄色火焰的是NaCl,有紫色火焰的是KNO3(透过钴玻璃片);
(16)分别取少量溶液于试管中,再分别滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成的是NaCl溶液,没有沉淀生成的是KNO3溶液。[注:(15)、(16)的答案可以互换]
:Ⅰ、把不溶于液体的固体和液体分离的方法就是过滤;故填:过滤
Ⅱ、在蒸发结晶时用玻璃棒不断搅拌是为了溶液局部过热而飞溅,故填:溶液局部过热而飞溅
Ⅲ、碳酸根离子的检验方法就是滴加稀盐酸,如果产生能够使澄清石灰水变浑浊的气体,说明有碳酸根离子,所以现象是有气泡产生,石灰水变浑浊.根据现象可知没有钡离子,应该先加入过量稀盐酸,提供酸性条件,再加Na2SO4引进硫酸根没有沉淀说明没有钡离子,即第二种猜想错误.检验硫酸根应该加入硝酸钡和稀硝酸,如果有沉淀生成说明有硫酸钠;故答案为:有气泡产生,石灰水变浑浊;加入过量的稀盐酸,Na2SO4;猜想二不成立;加入硝酸钡和稀硝酸,有白色沉淀生成;
Ⅳ.鉴别NaCl和KNO3溶液的两种方法:(1)分别取少量溶液于试管中,再分别滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成的是NaCl溶液,没有沉淀生成的是KNO3溶液. (2)焰色反应实验有黄色火焰的是NaCl,有紫色火焰的是KNO3(透过钴玻璃片)
