(7分)某化学兴趣小组拟用下图装置对某粗锌样品进行纯度检测。请填写以下实验报告。
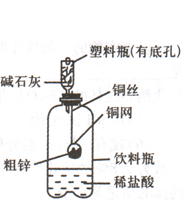
(1)实验目的: ;
(2)实验步骤:
①称取10.0 g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0 g。
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为 ;
③反应完全后,称得装置总质量为119.8 g,则粗锌的纯度为 ;
(3)问题探究:(已知碱石灰为.Na()H和CaO的混合物)
①该实验中碱石灰的作用是 ;若不用碱石灰,则所测得的粗锌纯度将 ;(填“偏大”、“偏小”或“无影响”)。
②若将粗锌换成石灰石,原实验方案 ;(填“能”或“不能”)用于石灰石样用于石灰石样品纯度的测定,理由是 。
(1)测定粗锌样品中锌的质量分数(或纯度)
(2)②Zn+2HCl==ZnCl2+H2↑ ③65%
(3)①吸收水蒸气、氯化氢气体 偏大 ②不能 碱石灰能吸收反应生成的CO2
②、铜网不与盐酸反应,锌能与盐酸反应.③、反应前后装置的质量差是氢气的质量,再利用方程式求解即可.
(3)1、碱石灰能吸收水蒸气与氯化氢气体,这样可使氢气的质量更准确一些.
2、二氧化碳能与碱石灰反应,使产生气体的质量无法测量,所以该实验不可行.
