某化学兴趣小组的同学对 “硫酸、硝酸钡、氢氧化钠、碳酸钠”四种物质之间的反应进行了定性和定量的研究。根据复分解反应发生的条件,初步判断上述四种溶液两两之间能发生 个反应;其中有气体、沉淀生成的化学方程式为:(请各写出一个)
(1) ;(2) 。
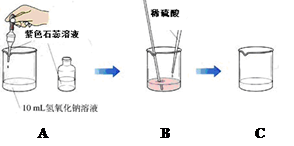
【实验一】证明氢氧化钠溶液和稀硫酸混合后确实发生了化学反应
王同学按下列方法进行了实验:
请回答:
在A的实验中,滴入紫色石蕊溶液的目的是 ;
B装置中发生的化学反应方程式为 ;
|
刘同学称取38.2g氢氧化钠和碳酸钠的混合溶液于烧杯中,
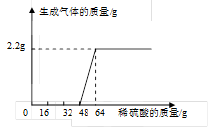
向其中逐滴滴加质量分数为15.3%的稀硫酸,同时记录实验数据,
测得加入稀硫酸的质量与生成气体的质量关系如右图所示。
①当加入16g稀硫酸时,溶液中的溶质
为 (写化学式)
②求混合物与稀硫酸恰好完全反应时所得
溶液的溶质质量分数。(请写出计算过程,结果保留到0.1%)
【实验三】实验分析四种化合物溶液混合后的成分
洪同学按以下流程进行了实验:
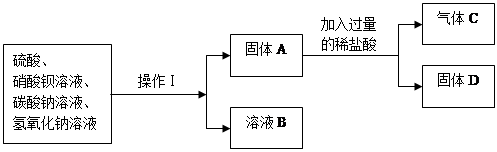
操作Ⅰ的名称是 ,固体D的化学式是 ;
如溶液B中滴入酚酞,呈无色,则B中一定没有 离子;一定含有 离子。
4 ; (1)Na2CO3+ H2SO4 =Na2SO4+H2O+CO2↑ ,
(2) H2SO4+Ba(NO3)2 =BaSO4↓+ 2HNO3 或 Ba(NO3)2+Na2CO3=BaCO3 ↓+ 2NaNO3
【实验一】证明氢氧化钠溶液和稀硫酸是否发生反应 ; 2NaOH + H2SO4 = Na2SO4 + 2H2O
【实验二】①NaOH、Na2CO3、Na2SO4
②(4分)(方法一)
解:当混合物与稀硫酸恰好完全反应时所用稀硫酸中溶质的质量为
64g×15.3% ≈ 9.8g
当混合物与稀硫酸恰好完全反应时所得溶液中的溶质质量为:
9.8g×(142/98)=14.2g
当混合物与稀硫酸恰好完全反应时所得溶液中的溶质质量分数为:
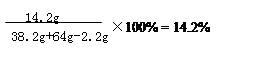
(方法二)
解:设:与碳酸钠反应的稀硫酸质量为x,生成硫酸钠的质量为y
Na2CO3+ H2SO4 = Na2SO4+H2O+CO2↑
98 142 44
15.3%·x y 2.2g
98
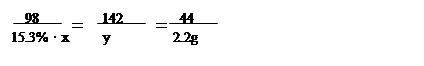
x="32g" ; y=7.1g
与氢氧化钠反应的硫酸质量为(64g-32g)×15.3%=4.9g
设:与氢氧化钠反应生成的硫酸钠的质量为z
2NaOH + H2SO4 = Na2SO4 + 2H2O
98 142
4.9g z

Z=7.1g
当混合物与稀硫酸恰好完全反应时所得溶液中的溶质质量分数为: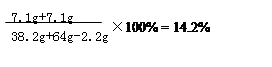
【实验三】过滤;BaSO4; OH-;Na+、NO3-。
根据物质的性质进行分析,物质间混合时若能生成沉淀、气体或水,则反应能够进行,氢氧化钠与稀硫酸反应生成硫酸钠和水,没有明显的实验现象,可以通过指示剂进行指示,在氢氧化钠和碳酸钠的混合液中加入硫酸,硫酸先与氢氧化钠反应,再与碳酸钠反应,根据图象提供的数据进行计算,分离不溶性固体和可溶性固体使用过滤的方法,酚酞在碱性溶液中为红色,在中性和酸性溶液中为无色.