某活动小组的同学对碳酸钠与稀盐酸反应进行了下列探究:
【探究一】向放有一支燃着的蜡烛的烧杯中加适量碳酸钠和盐酸(如图所示):
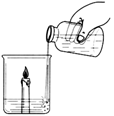
(1)蜡烛燃烧变化的现象是: 。
(2)根据该实验现象推测碳酸钠与盐酸反应产生的气体可用于 (写出用途)。
【探究二】利用碳酸钠与盐酸的反应,可否用于验证质量守恒定律进行了探究,实验如下,如图所示,

在(吸滤)瓶中加入适量的碳酸钠粉末,在小试管中加入盐酸。将小试管放入吸滤瓶中,并用止水夹夹住支管处的橡皮管。称量整个装置的质量,记录读数。将吸滤瓶倾斜,使小试管中的盐酸倾倒入瓶中,与碳酸钠粉末反应。可观察到如图二所示的现象。再次称量整个装置的质量,记录读数。
两次读数 (填“是”或“否”)相等。理由是 。
【探究三】碳酸钠与盐酸反应后剩余溶液的成分探究(假设二氧化碳已完全放出,杂质溶于水,不参加反应且呈中性)。甲、乙两同学分析认为剩余溶液中一定含有氯化钠,可能有盐酸或碳酸钠。为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论。
查找资料:氯化钠溶液呈中性
| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取样于试管中,滴加 试液 | 试液变红 | 有盐酸 |
| 乙 | 取样于试管中,逐滴滴加碳酸钠溶液 |
(1)产生的二氧化碳的质量为 g。
(2)纯碱样品中碳酸钠的质量(写出计算过程)。
【探究一】(1)蜡烛熄灭 (2)灭火
【探究二】是 在密闭容器中反应,符合质量守恒定律(或否,因为气球受到空气浮力,导致称量不准确)
【探究三】紫色石蕊 有气泡产生
【探究四】(1)6g+40g-43.8g=2.2g
(2)解:设Na2CO3的质量为x
Na2CO3+2HCl ====2NaCl+H2O+CO2↑
106 44
x 2.2g
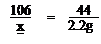
x=5.3g
答:纯碱样品中Na2CO3的质量为5.3g。
【探究一】碳酸钠与稀盐酸反应可生成二氧化碳,Na2CO3+2HCl=2NaCl+H2O+CO2↑二氧化碳具有灭火性,会使燃烧的蜡烛熄灭;由于二者反应速度较快,可以迅速产生大量的二氧化碳气体可用于灭火。
【探究二】 在密闭容器中反应,符合质量守恒定律(或因为气球受到空气浮力,导致称量不准确)
【探究三】紫色石蕊遇酸变红色,故甲操作过程中滴加的为紫色石蕊;Na2CO3与盐酸反应Na2CO3+2HCl=2NaCl+H2O+CO2↑,有气体二氧化碳产生,故可观察到有气泡产生。
【探究四】根据题意和化学方程式Na2CO3+2HCl ===2NaCl+H2O+CO2↑可知,产生二氧化碳的质量=6g+40g-43.8g=2.2g,将二氧化碳的质量代入化学方程式即可计算出样品中Na2CO3的质量。
