(7分)在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
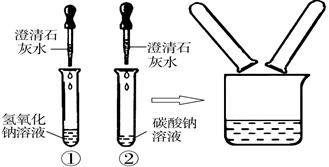
(1)写出试管②中碳酸钠与氢氧化钙反应的化学方程式:
。
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是 (写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由。
【实验设计】设计一个简单的实验证明你的猜想正确。
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,
| 你的猜想正确 |
道? 。
(1)Na2CO3 + Ca(OH)2 ="==" CaCO3↓ + 2NaOH(2分)
(2)[猜想]氢氧化钠和氢氧化钙(1分)
[讨论]小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存(1分)
[实验设计] 实验步骤:通入二氧化碳气体(或滴加可溶性碳酸盐溶液)(1分)
实验现象:试管中出现白色浑浊(1分)
[反思拓展] 在废液中加酸至溶液的pH=7(1分)
(1)碳酸钠和氢氧化钙反应生成白色的碳酸钙沉淀和氢氧化钠,反应的方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)猜想:根据反应原理可知,两者可能恰好完全反应,也可能其中的一种过量,结合已有的猜想,故猜想为:氢氧化钠和氢氧化钙;
讨论:碳酸根离子和钙离子会直接反应生成碳酸钙沉淀.所以,小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存;
实验设计:由于氢氧化钙溶液能与二氧化碳反应生成沉淀,所以,设计实验如下
| 实验步骤 | 实验现象 | 实验结论 |
| 取样品于试管中,通入二氧化碳气体 | 试管中出现白色浑浊 | 你的猜想正确 |
