(7分)在实验探究课上,老师给同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种。同学们为了确定该粉末的成分,进行如下探究。请你参与他们的探究并回答问题。
[提出问题]假设l:红色粉末是铜粉;
假设2:红色粉末是氧化铁粉;
假设3:红色粉末是 。
[设计实验方案]同学们对实验作了如下设想和分析:取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后高温至充分反应(实验装置图如下)。
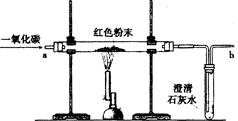
请你完成下表:
| 实验中可能出现的现象 | 结论 |
| 红色粉末不变色,石灰水不变浑浊 | 假设1成立 |
| 红色粉末全部变为黑色,石灰水变浑浊 | 假设2成立 |
| 假设3成立 |
[反思与评价]
(1)实验过程中,硬质玻璃管内发生的化学反应方程式为 。
(2)实验时通入一氧化碳片刻后再加热的原因是 。
(3)从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施是 。
[知识拓展]
(4)请你用另一种新的方法探究这包红色粉未的成分,探究方法 。
(5)为了进一步探究铁和铜的金属活动性强弱,你认为可选用下列试剂中的 (填序号)
A.硝酸铜溶液 B.稀盐酸 C.氯化锌溶液 D.硝酸银溶液
[提出问题] 假设3:铜粉和氧化铁粉的混合物
[设计实验方案]
| 实验中可能出现的现象 | 结论 |
| 红色粉末部分变为黑色,石灰水变浑浊 | 假设3成立 |
 2Fe+3CO2
2Fe+3CO2(2)防止加热时硬质玻璃管发生爆炸(或把玻璃管内空气排净)
(3)在b处用酒精灯点燃,或用塑料袋(气球)收集
(4)根据铜和氧化铁的不同性质分析,如氧化铁能与酸反应,铜不能与酸反应等
(5)AB
题目分析:[提出问题] 假设3:根据题干的所给的信息可以作出判断,该粉末是铜粉和氧化铁粉中的一种或两种,因此红色粉末可能为两物质的混合物。
[设计实验方案] 因为铜在高温下不与一氧化碳反应,氧化铁在高温下可与一氧化碳反应生成黑色铁粉和二氧化碳,因此充分反应后,粉末部分变黑色,澄清石灰水浑浊。
[反思与评价]
(1)实验过程中,硬质玻璃管内氧化铁在高温下与一氧化碳反应生成黑色铁粉和二氧化碳,故反应的化学反应方程式为3CO+Fe2O3 2Fe+3CO2。
2Fe+3CO2。
(2)一氧化碳具有可燃性,与空气混合点燃可能发生爆炸,因此应先通一氧化碳,排出玻璃管中的空气,待玻璃管内气体为纯净的一氧化碳时再进行加热,防止形成混合气体而引起爆炸。
(3)从环保角度看,上面的实验装置有不足之处:即一氧化碳有毒,排放到空气中会引起空气的污染,故应该加一个尾气处理装置,例如在b处用酒精灯点燃,或用塑料袋(气球)收集等。
[知识拓展]
(4)因为铜不能和酸反应,而氧化铁能与酸反应,且溶液变成黄色,所以方案为:取少量红色粉于试管中,加入足量的稀盐酸充分反应;如果试管中的红色固体不变,溶液不变色,则猜想1成立;如果试管底部没有红色固体剩余,溶液变为黄色,则猜想2成立;如果试管底部有红色固体剩余,溶液变为黄色,则猜想3成立。
(5)在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来。
A、铁在铜的前面,铁能与硝酸铜溶液反应生成铜,而铜不能与硝酸铜溶液反应,故可以使用硝酸铜溶液确定铁和铜的活动性强弱;
B、Fe>H>Cu,故铁能与稀盐酸反应生成氢气,而铜不与稀盐酸反应生成氢气,现象不同,故可以使用稀盐酸确定铁和铜的活动性强弱;
C、Zn>Fe>Cu,所以铁和铜都不能与氯化锌溶液反应,故使用氯化锌不能确定铁和铜的活动性强弱;
D、Fe>Cu>Ag,所以铁和铜都能与硝酸银溶液反应,且现象相同,故不可以使用硝酸银溶液确定铁和铜的活动性强弱。故选AB
点评:在作出猜想的时候要抓住题给的蛛丝马迹来进行猜想,不能盲目的乱猜,另外不纯的气体在点燃时有可能出现爆炸,所以在使用可燃性气体时,一定要注意检验气体的纯度。要会利用金属活动顺序表设计实验,去验证金属的活动性强弱,氢前边的金属会与稀硫酸、盐酸反应,但氢后的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
