(8分)近几年我国某些城市空气受到污染,形成酸雨较为严重,主要是因为大量燃烧含硫量高的煤而形成的;此外,各种机动车排放的尾气也是形成酸雨的重要原因。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 H2SO4。
(1)高锰酸钾中锰元素的化合价为 价。
(2)二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊。请写出二氧化硫与澄清石灰水反应的化学方程式: (2分)。
根据上述资料,甲同学、乙同学、丙同学分别设计实验方案进行探究。
【实验探究】(3)甲同学的实验操作:甲同学进行了如下图所示A、B两步实验:

“实验现象”: A中稀高锰酸钾溶液褪色, B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是: 。
(5)丙同学的实验操作:丙同学进行了如图所示实验(部分装置在图中略去)
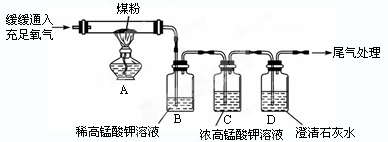
【探究与结论】(6)上图C装置的作用是 。
(7)要证明煤中含有碳元素和硫元素,丙同学实验中的现象是:B
C D 。
(1)+7(1分) (2)SO2+Ca(OH)2 = CaSO3↓+H2O(2分) (4)二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素(1分)(6)除去过多的二氧化硫或排除二氧化硫的干扰(1分) (7)B中的溶液褪色,(1分)C中的溶液不褪色,(1分)D中澄清的石灰水变浑浊 (1分)。
题目分析:(1)根据在化合物中,正负化合价的代数和为零来解答,KMnO4中K元素化合价为+1,氧元素的化合价为-2,设Mn的化合价为x,可得(+1)+x+(-2)×4=0,解得x=+7;
(2)由题意可知,二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,说明二氧化硫与澄清石灰水反应有沉淀生成,故该反应的化学方程式为SO2+Ca(OH)2 = CaSO3↓+H2O;
(4)由题意可知,二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,所以甲同学的实验操作中的澄清石灰水变浑浊的现象不能证明有二氧化碳的生成,也就不能判断煤中含有碳元素,故甲同学的实验方案不合理;
(6)由于二氧化硫的存在会影响对二氧化碳的检验,所以检验二氧化碳之前,要先将二氧化硫除去,结合高锰酸钾的特点可知,图中C装置的作用是除去过多的二氧化硫或排除二氧化硫的干扰;
(7)结合题意可知,要证明煤中含有碳元素和硫元素,就要先验证二氧化硫,再除去二氧化硫,最后再验证二氧化碳,即丙同学实验中的现象是:B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊。
点评:本考点探究了煤炭的组成元素,属于实验探究题,既有实验过程的探究,又有结论的探究,还考查了学生的实验评价能力,要能找出实验的不足之处,并加以改进。
