(7分)同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶。同学们通过如下实验进行相关研究。
实验一:验证二氧化锰能加快过氧化氢的分解速率
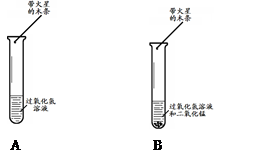
分别取5 mL 5%的过氧化氢溶液于两支试管中,向B中试管内加入少量二氧化锰(如上图所示)。A中带火星的木条不复燃,B中带火星的木条复燃,实验证明二氧化锰加快了过氧化氢的分解速率。A中木条不复燃的原因是 ,B中反应的化学方程式是 。
实验二:研究催化剂的某些因素对过氧化氢分解速率的影响
方案Ⅰ:分别取20 mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中。向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如右图所示)。测定数据如下表所示:

 时间/s 时间/s试剂 压强/KPa | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL 5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁溶液 | 102.21 | 105.35 | 115.40 | 129.69 | 145.52 | 163.99 |
| 加入氯化铜溶液 | 101.50 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
(2)根据上表数据得出的结论是 。
方案Ⅱ:从同一部位取2个质量均为1.7 g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,同时分别放入盛30 mL 5%过氧化氢溶液的50 mL量筒中。均看到有气泡生成,一段时间,只有土豆片不断上升。通过实验得出的结论是 。
【实验反思】通过实验一和实验二说明,测量不同的物理量可判断过氧化氢的分解速率。
下列做法中能比较过氧化氢的分解速率的是 (填选项序号)。
A. 测量完全反应后气体的总体积 B. 测量相同时间内产生气体的体积
C. 测量相同时间内体系压强的变化 D. 测量相同时间内溶液质量的变化
实验一:常温下,过氧化氢分解速率缓慢产生氧气量很少,不足以使带火星的木条复燃。 2H2O2==== 2H2O+O2↑
实验二:Ⅰ(1)控制金属离子的数目,对比它们对过氧化氢分解的速率影响。
(2)氯化铁溶液催化产生氧气的速率比氯化铜溶液快。(不同种类的催化剂对过氧化氢分解速率影响不同)
Ⅱ反应物和催化剂的接触面接越大,反应速率越快。(反应速率与反应物和催化剂的接触面积有关)
【实验反思】BCD (0,2)
题目分析:实验一:A中木条不复燃的原因是常温下,过氧化氢分解速率缓慢产生氧气量很少,不足以使带火星的木条复燃,B中反应的化学方程式是2H2O2==== 2H2O+O2↑;
实验二:
方案Ⅰ:(1)加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,该步操作的实验目的是控制金属离子的数目,对比它们对过氧化氢分解的速率影响。
(2)根据上表数据可知,氯化铁溶液催化过氧化氢,用相同的时间,得到的氧气最多,故得出的结论是氯化铁溶液催化产生氧气的速率比氯化铜溶液快。
方案Ⅱ:由题意可知,切片的土豆,对过氧化氢的催化效果好于土豆块,故可得出反应物和催化剂的接触面接越大,反应速率越快。
【实验反思】以下做法能比较过氧化氢的分解速率,即B. 测量相同时间内产生气体的体积;C. 测量相同时间内体系压强的变化;D. 测量相同时间内溶液质量的变化。
点评:氧气具有助燃性,能使带火星的木条复燃;
催化剂能改变化学反应的速率,但其本身在化学反应前后,化学性质和质量保持不变。