(7分)有一包白色的固体粉末,可能是NaHCO3、NaOH中的一种或二种,化学小组对其组成进行如图所示的实验:
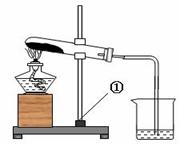
资料:1.酒精灯加热温度约500~600 ℃;
2. NaOH 318.4℃熔化不分解,1390 ℃沸腾不分解;
3. Na2CO3+CaCl2→CaCO3↓+ 2NaCl
4. Na2CO3溶液呈碱性;CaCl2溶液呈中性
(1)完成实验报告的内容:
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量的白色粉末加热,将产生的气体通入小烧杯中,至无气体产生时,停止加热 (小烧杯内盛有澄清的石灰水) | 试管内壁有无色液滴,石灰水变浑浊,试管内剩余白色固体物质 | 粉末中一定含有
反应的化学方程式是
|
| ②取实验①所剩余白色固体少量于试管中,向试管中加入稀盐酸 | 实验①所剩余白色固体中一定含有 ; 反应的化学方程式是
|
(1)①NaHCO3 ②2NaHCO3→Na2CO3+ H2O+CO2 ③有气体产生
④Na2CO3⑤Na2CO3+2HCl→2NaCl+ H2O+CO2↑
(2)⑥加水溶解,加入过量的CaCl2溶液使沉淀完全,静置后向上层清液中滴加酚酞溶液。若溶液变红,则产物中有NaOH;若溶液不变色,则产物中没有NaOH(2分)
题目分析:(1)
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量的白色粉末加热,将产生的气体通入小烧杯中,至无气体产生时,停止加热 (小烧杯内盛有澄清的石灰水) | 试管内壁有无色液滴,石灰水变浑浊,试管内剩余白色固体物质 | 粉末中一定含有 NaHCO3 。 反应的化学方程式是2NaHCO3=Na2CO3+ H2O+CO2 |
| ②取实验①所剩余白色固体少量于试管中,向试管中加入稀盐酸 | 有气体产生 | 实验①所剩余白色固体中一定含有 Na2CO3; 反应的化学方程式是:Na2CO3+2HCl=2NaCl+ H2O+CO2↑
|
点评:推断物质,要根据物质的性质,设计合理的实验,通过特有的反应现象来确定。读懂题中信息,结合题目中的考点,是解答本题的关键。
