有一包未知粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种。兴趣小组为确定其组成设计并进行如下实验。
【实验一】甲组同学进行定性探究。
| 实验操作 | 实验现象 | 实验结论及分析 |
| (1)取少量该未知粉末于烧杯中,加入足量的水溶解、过滤。 | 粉末部分溶解, 得到白色滤渣和无色滤液。 | 原粉末中一定不含_____; 白色滤渣不一定是原粉末中的碳酸钙,其理由是_____(用化学方程式表示)。 |
| (2)向滤液中滴加无色酚酞试液。 | 溶液变红 | 滤液中存在碱性物质。 |
| (3)向(2)中滴加足量稀盐酸。 | 原固体粉末中一定含有Na2CO3。 |
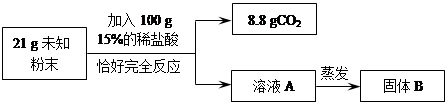
实验测得固体B中含15 g氯元素。试综合甲、乙两组同学的实验进行分析。
(1)乙组实验中一定发生的化学反应是:Na2CO3+ 2HCl=2NaCl + H2O+ CO2↑和 。
(2)该未知粉末的组成可能是 。
| 实验操作 | 实验现象 | 实验结论及分析 |
| 一定不含 硫酸铜 , CaO+H2O=Ca(OH)2 Na2CO3+ Ca(OH)2=CaCO3↓+2NaOH | ||
| 溶液由红色变为无色,有气泡生成 |
(1)CaCO3+ 2HCl=CaCl2 + H2O+ CO2↑
(2)Na2CO3 、NaCl、CaCO3、NaOH 或Na2CO3 、NaCl、CaCO3、CaO (2分)
题目分析:【实验一】(1)粉末部分溶解,得到白色滤渣和无色滤液。则原粉末中一定不含硫酸铜,因为硫酸铜溶液是蓝色的;白色滤渣不一定是原粉末中的碳酸钙,其理由是CaO+H2O=Ca(OH)2 ;Na2CO3+ Ca(OH)2=CaCO3↓+2NaOH。
(3)向(2)中滴加足量稀盐酸。溶液由红色变为无色,有气泡生成,则原固体粉末中一定含有Na2CO3。
【实验二】向未知粉末中加入稀盐酸,反应并产生二氧化碳,一定有的反应是Na2CO3+ 2HCl=2NaCl + H2O+ CO2↑和CaCO3+ 2HCl=CaCl2 + H2O+ CO2↑。因为甲组同学的实验已经表明,不管是原有的碳酸钙,还是氧化钙反应生成的碳酸钙,都将有碳酸钙与盐酸反应,产生二氧化碳气体。
(2)因100 g15%的稀盐酸中含有氯元素100g×15%×(35.5/36.5)×100%=14.6g,小于实验测得的氯元素15g,故该粉末中一定含有氯化钠,故该未知粉末的组成可能是Na2CO3 、NaCl、CaCO3、NaOH 或Na2CO3 、NaCl、CaCO3、CaO。
点评:鉴别物质,要根据物质的性质,通过特有的化学反应现象来推测;
书写化学方程式要遵循客观事实和质量守恒定律两个原则,注意化学式要正确,不要忘记反应条件、气体或者沉淀符号。
化合物中某元素的质量分数=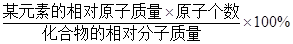 。
。

