下图是元素周期表的一部分.已知从左到右元素的性质呈现以下特点:金属性逐渐减弱,非金属性逐渐增强;金属对应的碱碱性逐渐减弱,非金属对应的酸酸性逐渐增强.回答以下问题:
| 11 Na 钠 | 12 X ______ | 13 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 Y ______ | 17 Cl 氯 |
②.原子序数为11、13的两元素的金属活动性强弱为(用元素符号表示):______>______.
③.原子序数为16号的元素Y对应的酸化学式为H2YO4,其中Y的化合价为______.
④.原子序数为15的元素形成酸的化学式为H3PO4原子序数为16的元素形成酸的化学式为H2SO4,其中酸性较弱的是(用化学式表示)______.
⑤.铝在实际生活中既能跟酸反应,也能与部分碱反应,如果将铝放入热的氢氧化钠水溶液中,将生成偏铝酸钠(NaAlO2)和氢气,试写出此反应的化学方程式______.
①因X的原子序数为12,则为镁元素,属于金属元素,Y的原子序数为16,则为硫元素,属于非金属元素,故答案为:金属;非金属;
②原子序数为11的是钠元素,原子序数为13的是铝元素,根据从左到右元素的性质呈现特点为金属性逐渐减弱,则金属活动性Na>Al,故答案为:Na;Al;
③由化学式为H2YO4,H元素的化合价为+1价,O元素的化合价为-2价,根据化合物中正负化合价的代数和为0,则Y元素的化合价为0-(+1)×2-(-2)×4=+6,故答案为:+6;
④因P、S都是非金属元素,根据从左到右元素的性质非金属性逐渐增强,非金属对应的酸的酸性逐渐增强,则酸性H2SO4>H3PO4,故答案为:H3PO4;
⑤因铝放入热的氢氧化钠水溶液中,生成偏铝酸钠(NaAlO2)和氢气,反应为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.

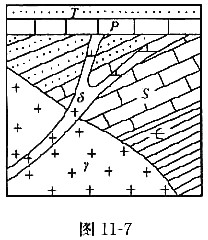
 与S整合接触
与S整合接触 、S沉积接触
、S沉积接触 、S呈侵入接触
、S呈侵入接触