请你参与某学习小组研究性学习的过程,并协助完成相关任务。
【研究课题】探究水壶内部水垢的主要成分
【查阅资料】通过查阅资料知道,天然水和水垢所含的物质及其溶解性如下表:
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
【设计方案】
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,静置。取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无 (填化学式)。
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分。
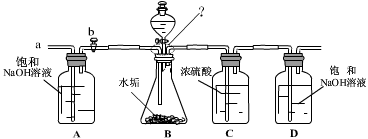
其主要实验步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,逐滴加入足量稀盐酸。若D瓶增重22g,则水垢全部是CaCO3。
②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气;
③称量D瓶内物质增加的质量;
④重复②和③的操作,直至D瓶内物质质量不变。
测量滴加稀盐酸体积与D瓶内物质增加质量的关系如 右图曲线所示;

【评价】
(1)A瓶中的NaOH溶液起到 作用。若A瓶中无 NaOH 溶液,D瓶中的质量将 (填“增大”、“不变”或“减小”)。
(2)一般情况下,两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多。分析曲线图可知:水垢中一定含有
(化学式),理由是 。
【提出猜想】CaCO3 MgCO3
【设计方案】⑴ Ca(OH)2
【评价】⑴吸收CO2 增大 (2)MgCO3 实际生成CO2的质量是24g,大于22g
题目分析:【提出猜想】水垢为固体,所以水垢的主要成分应该是不溶的或是微溶的物质,结合题给的“查阅资料”部分可知,不溶的是Mg(OH)2和CaCO3,可溶的是Ca(OH)2和MgCO3。
【设计方案】(1)结合猜想分析,向上层清夜中加入碳酸钠时,如果存在着氢氧化钙,就会产生沉淀,但是实验结果是没有沉淀产生,所以可判断水垢中没有氢氧化钙。
【评价】(1)由于空气中含有二氧化碳,所以在通入空气时,要把空气中的二氧化碳除去,如果不除去空气中的二氧化碳,则会导致D装置中的氢氧化钠多吸收了二氧化碳,所以会导致D瓶的质量增加。
(2)根据题给条件可知,如果全部是碳酸钙则生成22g气体,而题目中生成了24g二氧化碳,再根据“两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多”,根据Mr(MgCO3)=84小于Mr(CaCO3)=100,则可以判断在水垢中还含有碳酸镁。32-检验方法),实验探究物质的组成成分以及含量,碱的化学性质,碳酸钠、碳酸氢钠与碳酸钙,酸碱盐的溶解性,常见离子的检验方法及现象
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。
