用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验.

【查阅资料】①无水硫酸铜为白色固体,遇水变成蓝色。
②浓硫酸具有吸水性,可做干燥剂。
请根据资料回答:
(1)在实验中,乙装置的作用是 .
(2)准确称取完全反应前后装置丙和丁的质量如表:
| 装置丙 | 装置丁 | |
| 反应前 | 48.8克 | 161.2克 |
| 反应后 | 46.5克 | 163.9克 |
(3)小明根据装置丙的质量变化计算,发现小丽结果偏大。请分析导致这一结果的原因可能是 .
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.氧化铜没有完全被还原
(1)检验氢气中水分是否全部被吸收 (2)80% (3) B
题目分析:(1)根据图示分析,氢气通过浓硫酸,是为了除去氢气中的水分,而无水硫酸铜遇到水会由白色变蓝色,所以再通过无水硫酸铜就是检验浓硫酸是否把氢气中的水分完全除尽。
(2)由于浓硫酸具有吸水性,故丁中浓硫酸质量的增加量就是反应生成的水的质量,再根据水的质量,利用反应的方程式中水与氧化铜的质量比,计算出氧化铜的质量,最后计算纯度即可。
解:根据浓硫酸质量的增加量就是生成的水的质量可知,生成水的质量=163.9g-161.2g=2.7g。
设要生成2.7g水需要参加反应的氧化铜的质量为X。
H2 + CuO Cu + H2O
Cu + H2O
80 18
X 2.7g
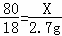
解得X=12g
则氧化铜的质量分数=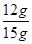 ×100%="80%"
×100%="80%"
(3)根据题意,小丽根据装置丁的质量变化进行计算的结果偏大,说明丁装置中吸收的水的量偏大,故其原因是由于浓硫酸与空气相通,吸收了空气中的水分而变大。故选B
点评:本题主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力;解题的关键是要明确浓硫酸的增加量即为反应生成水的质量,然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范;此外,最后的问题探究,要考虑浓硫酸的吸水性,不仅吸收了生成的水,而且吸收了空气中的水。
