某兴趣小组利用下图装置(夹持装置略去),测定某种补钙剂中的含钙量。
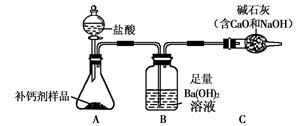
【查得资料】
①该补钙剂的主要成分是碳酸钙,其他成分遇到盐酸时无气体生成且不含钙元素。 ② 二氧化碳通入足量的氢氧化钡溶液中,会生成白色碳酸钡沉淀[Ba(OH)2+CO2 = BaCO3↓+H2O]
【测定方法】
通过测定B装置中产生沉淀的质量,以确定碳酸钙的质量分数,进而求出钙元素的质量分数。
(1)碳酸钙属于________( 填“酸”、“碱”或“盐”)。
【进行实验】
实验过程中,装置气密性良好。取12g该补钙剂样品进行实验。
(2)观察到:A装置中___ _____,固体逐渐溶解;B装置中产生白色沉淀,实验结束后过滤并称得沉淀质量为19.7g,则该补钙剂中钙元素的质量分数为 %。(结果精确到0.1% )
(3)从A装置中导出的气体除了二氧化碳和水蒸气外,还含有氯化氢。请写出氢氧化钡溶液与氯化氢气体反应的化学方程式:____ ____。
【交流讨论】
通过小组讨论提出改进实验装置的措施:在A、B装置之间增加洗气装置,以除去氯化氢气体。
(4)经改进后,实验 。
(5)C装置的作用是____ __。
(1)盐;(2)产生大量气泡 33.3;(3)Ba(OH)2 + 2HCl = BaCl2 + 2H2O;
(4)产生的二氧化碳气体没有全部进入B装置被氢氧化钡溶液吸收;(5)防止外界空气中的二氧化碳气体和水蒸气进入B装置,干扰实验测定。
题目分析:由题意得:
(1)碳酸钙有碳酸根离子和钙离子构成,属于盐。
(2)观察到:A装置中产生大量气泡,固体逐渐溶解;B装置中产生白色沉淀,实验结束后过滤并称得沉淀质量为19.7g,则该补钙剂中钙元素的质量分数为33.3%。(结果精确到0.1% )。
解:设,反应生成的二氧化碳的质量为X
CO2 + Ba(OH)2 = BaCO3↓+ H2O
44 197
X 19.7g
44:197=X:19.7g
X=4.4g
CaCO3 +2HCl=CaCl2 + 2H2O+ CO2↑
100 44
Y 4.4g
100:44=Y:4.4g
Y=10g
10g×(40/100)×100%=4g
(4/12)×100%=33.3%。
(3)从A装置中导出的气体除了二氧化碳和水蒸气外,还含有氯化氢。氢氧化钡溶液与氯化氢气体反应的化学方程式:Ba(OH)2 + 2HCl = BaCl2 + 2H2O。
(4)经改进后,实验产生的二氧化碳气体没有全部进入B装置被氢氧化钡溶液吸收。
(5)C装置的作用是防止外界空气中的二氧化碳气体和水蒸气进入B装置,干扰实验测定。
点评:本题综合性较强,考查的内容较多,难度较大,解题的关键在于依据物质的流通过程,逐步分析各个不同部位的反应过程,理解不同实验装置的用途及其内部数字变化的意义。
