某化学兴趣小组的同学在探究Mg、Cu、Fe三种金属的有关性质时进行了如下实验:
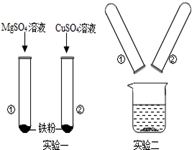
(1)实验一:发生反应的化学方程式 ,
该实验可得出三种金属的活动性由强到弱的顺序为
(2)实验二:将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,一段时间后过滤.滤渣中一定含有的物质是 ,可能有的物质是 ,为了进一步确定可能有的物质是否存在,同学们设计了如下方案:
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤渣于试管中,向其中滴加 | 没有气泡产生 |
①Mg2+; ②Mg2+、Fe2+; ③Mg2+、Fe3+; ④Cu2+、Fe2+; ⑤Mg2+、Fe2+、Cu2+.
(1)Fe + CuSO4 ="=" FeSO4 + Cu ; Mg Fe Cu
(2)Cu ; Fe
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤渣于试管中,向其中滴加HCl(H2SO4) | 没有气泡产生 | 滤渣中没有铁 |
题目分析:(1)铁能与硫酸铜反应,说明铁的活动性比铜强;铁不能与硫酸镁反应,说明镁的活动性比铁强,故三种金属的活动性由强到弱的顺序为Mg>Fe>Cu;其中铁与硫酸铜反应,生成铜和硫酸亚铁,故反应的化学方程式为Fe + CuSO4 = FeSO4 + Cu。
(2)将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,说明铁在继续与硫酸铜反应,生成铜和硫酸亚铁,故一段时间后过滤,滤渣中一定含有的物质是铜,可能有铁的剩余,也可能没有。
由于铁能与稀酸反应生成氢气,而铜不能,所以可取少量滤渣于试管中,并向其中滴加稀盐酸,若有气泡产生,说明含有铁,否则没有铁;
由于铁与硫酸镁不反应,所以滤液中一定含有镁离子;由于铁与硫酸铜反应,生成铜和硫酸亚铁,故溶液中还有亚铁离子的存在;由于不能确定硫酸铜是否完全反应,故不能确定溶液中是否有铜离子。故选②⑤
点评:理解和熟练掌握金属活动性顺序及其应用,是解答这类题的关键,即金属活动性顺序中位于氢之前的金属能从酸中置换出氢,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来。
