化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究。该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成,其他成分遇到盐酸时无气体生成。现利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。请回答下列问题。
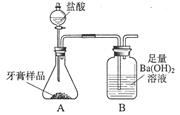
(1)装置A中牙膏样品放置在 (填仪器名称)中,盐酸放置在装置 (填仪器名称)中,A中至少发生 (填数字)个反应,写出其中一个反应的化学方程式 。
(2)若测定值比实际值小,可能的原因有 。(填字母)
a.装置A中水蒸气、HCl等进入装置B中 b.装置A中CO2未完全进入装置B
c.CO2气流速度太快导致Ba(OH)2未完全吸收 d.盐酸未滴加过量
(3)为减少误差,现采取以下一些措施:
①在A、B之间增加一个装有 (填化学式)溶液的洗气瓶,它的作用是 _;
②将装置B中的长导管下方增加一个带孔球泡,可以提高 ;
③在装置B的后面再增加一个装有 (填药品名称或化学式)固体的干燥管,目的是 。
(4)准确称取三份各16.00 g的样品,进行测定,测得BaCO3质量分别为3.96 g、3.92 g、3.94 g。请计算样品中碳酸钙的质量分数。 。(写出计算过程,4分)
(5)某同学利用上述方法测定牙膏中钙元素的质量分数。小李同学认为即使排除实验仪器和操作的影响,上述测定的结果仍有可能偏小,理由是 。
(1)锥形瓶 分液漏斗 2 CaCO3+2HCl=CaCl2+H2O+CO2↑或Al(OH)3+3HCl=AlCl3+3H2O
(2)②③④
(3)①AgNO3,除去HCl气体 ②二氧化碳吸收效率 ③碱石灰或氧化钙等 防止空气中的CO2进入装置B
(4) 测得碳酸钡的质量为(3.96g +3.92g +3.94g)÷3= 3.94g (1分)
参加反应的碳酸钙质量为2g(2分)
碳酸钙的质量分数为12.5%(1分)
(5)牙膏中可能含有钙的其它化合物(或其他合理答案)。
题目分析:(1)根据实验室常用仪器回答,图中装置A中的牙膏样品放置在锥形瓶中;盐酸放置在分液漏斗中;根据题意,A中至少发生2个反应:盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,盐酸和氢氧化铝反应生成氯化铝和水,故反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,Al(OH)3+3HCl=AlCl3+3H2O。
(2)根据题意,A中生成的二氧化碳会进入B而被B吸收,实验就是通过测定B中生成的BaCO3沉淀质量,以确定生成二氧化碳的质量,从而确定碳酸钙的质量分数。
a.若装置A中水蒸气、HCl等进入装置B中,会造成B装置后来的称重变大,即测定生成二氧化碳的质量偏大,故造成结果偏大;
b.若装置A中CO2未完全进入装置B,则测定生成二氧化碳的质量偏小,故造成结果偏小;
c.若CO2气流速度太快导致Ba(OH)2未完全吸收,即部分二氧化碳气体逸出,则测定生成二氧化碳的质量偏小,故造成结果偏小;
d.若盐酸未滴加过量,则碳酸钙未能完全反应,故生成二氧化碳的质量偏小,故造成结果偏小。故选②③④
(3)根据上面的分析,①为防止HCl进入B装置,可在A、B之间增加装有硝酸银的装置;
②将装置B中的长导管下方增加一个带孔球泡,可增大二氧化碳与氢氧化钡溶液的接触面积,从而提高二氧化碳的吸收效率;
③在装置B的后面再增加一个装有碱石灰或氧化钙等药品的装置,可以阻止空气中的二氧化碳进入装置B,影响结果的测定。
(4)为了确保实验结果的误差更小,应使用3次实验的平均值,即测得碳酸钡的质量为(3.96g +3.92g +3.94g)÷3= 3.94g
设样品中碳酸钙的质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑,CO2+Ba(OH)2= BaCO3↓+H2O
CaCO3→CO2→BaCO3
100 197
16g•x 3.94g
100:16g•x =197:3.94g
解得x=12.5%
(5)由于牙膏中可能含有钙的其它化合物,而根据题意,它们都不能与盐酸反应产生气体,故利用上述方法测定牙膏中钙元素的质量分数时,结果会偏小。
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。
