某学习小组在探究酸的化学性质时,做了如下两个实验:
(1)分别向两支装有碳酸钠和碳酸钙粉末的试管中注入一定量的稀盐酸,均观察到的现象是 ,固体粉末全部消失,最终形成无色溶液。写出其中一个反应的化学方程式: 。
。
(2)实验结束后,同学 们将两种反应后的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊。写出产生浑浊现象的化学方程式: 。
们将两种反应后的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊。写出产生浑浊现象的化学方程式: 。
小组同学将烧杯中的物质进行了过滤,对滤液中的溶质成分展开了探究,请你一起参与。
【提出猜想】猜想1:滤液中的溶质是氯化钠;
猜想2:滤液中的溶质是氯化钠和碳酸钠;
猜想3:滤液中的溶质是 。
【设计实验】请你选择一种猜想进行验证。
| 实验步骤 | 预计实验现象 | 预计结论 |
| 取少量溶液于试管中,
| 猜想 正确 |
产生大量气泡 Na2CO3 + 2HCl =" 2NaCl+" H2O + CO2↑(或者写碳酸钙和稀盐酸的反应方程式也行) Na2CO3+CaCl2=2NaCl+CaCO3↓ 氯化钠和氯化钙
滴加稀盐酸 产生气泡 二(也可以设计实验验证猜想一或猜想三正确,答案合理即可)
题目分析:(1)碳酸钠和碳酸钙均属于碳酸盐,均可以和稀盐酸反应生成相应的盐、水和二氧化碳,所以现象是产生大量气泡,反应方程式为Na2CO3 + 2HCl =" 2NaCl+" H2O + CO2↑和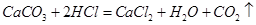 ;(2)废液中的成分可以发生反应生成沉淀,由题可知,是碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,方程式为Na2CO3+CaCl2=2NaCl+CaCO3↓,猜想3:滤液中的溶质可以是氯化钠和氯化钙;实验设计如下
;(2)废液中的成分可以发生反应生成沉淀,由题可知,是碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,方程式为Na2CO3+CaCl2=2NaCl+CaCO3↓,猜想3:滤液中的溶质可以是氯化钠和氯化钙;实验设计如下
| 实验步骤 | 预计实验现象 | 预计结论 |
| 取少量溶液于试管中, 滴加稀盐酸 | 产生气泡 | 猜想 二 正确 |
点评:这是一道非常典型的探究题,题目给的知识点没有学过,较为陌生,但是重点考察的反应的思想,装置等,所以这种题目不要害怕,仔细审题即可。
