氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物;
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气;
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得。某化学兴趣小组设计的制取装置如图1所示(固定装置省略)。
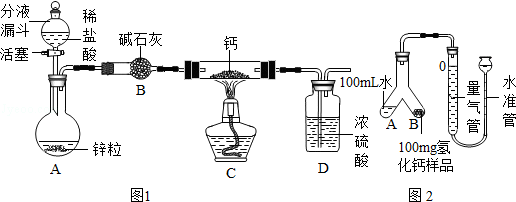
回答下列问题:
(1)装置A中制取氢气的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中制取氢化钙的化学方程式为 。
(4)若不改变温度,整套装置气密性的检查方法是 。
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
①检查装置气密性,装入药品,按图2(固定装置省略)所示连接仪器;
②调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0mL;
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合;
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0mL。
回答下列问题:
(5)如何判断样品与水完全反应: 。
(6)反应生成氢气的体积为 mL。
(7)已知该实验条件下,氢气的密度为0.09mg/mL,样品中氢化钙的纯度为 (结果精确到0.1%)。
(1)Zn+2HCl=ZnCl2+H2↑ (2) 吸收水蒸气和部分氯化氢气体 (3)Ca+H2 CaH2;
CaH2;
(4)将活塞关闭后,往分液漏斗中加入适量的水,用手指堵住装置D的导管口,打开活塞,若气密性良好,可观察到分液漏斗内的液面几乎不下降(合理答案均可);
(5)量气管中液面不再变化(合理答案均可);(6)100.0; (7)88.4%
题目分析:(1)依据锌粒与稀盐酸反应原理书写方程式。锌粒与稀盐酸反应生成氯化锌和氢气,反应的方程式是:Zn+2HCl=ZnCl2+H2↑;
(2)根据碱石灰的成分和其中物质的性质分析解答。碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体;
(3)依据反应物、生成物和反应条件书写方程式。钙和氢气在加热的条件下生成氢化钙,方程式是Ca+H2 CaH2;
CaH2;
(4)根据检查装置气密性的方法和题目要求分析解答。要检查该套装置的气密性,可以将活塞关闭后,往分液漏斗中加入适量的水,然后用手指堵住装置D的导管口,打开活塞,观察分液漏斗内的液面变化判断装置是否漏气;
(5)根据装置特点和氢化钙与水反应生成氢气进行分析。由于氢化钙与水反应生成氢气,所以判断样品与水是否完全反应,可以观察右边的量气管中液面,若不再变化,则已完全反应;
(6)氢气的体积等于反应前后液面差,为:110.0mL﹣10.0mL=100.0mL;
(7)依据氢气的质量=氢气的体积×氢气的密度求出氢气的质量,再结合氢化钙与水反应方程式及钙与水反应方程式,求出氢化钙的质量,进而计算样品中氢化钙的纯度。反应生成氢气的质量是:100.0mL×0.09mg/mL=9mg。设样品中氢化钙的质量是X,生成氢气质量为Y,则钙的质量为100mg﹣X,钙与水反应生成氢气质量为9mg﹣Y,则
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
X Y
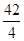 =
=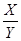
解得Y=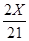
Ca+2H2O=Ca(OH)2+H2↑
40 2
100mg﹣X 9mg﹣Y
根据: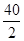 =
=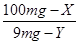
将Y=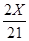 代入
代入
解得X=88.4mg
所以样品中氢化钙的纯度为: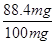 ×100%=88.4%。
×100%=88.4%。
