某化学兴趣小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后瓶中残留废液进行探究。
【提出问题】废液中所含溶质是什么?
【猜想与假设】
猜想1:废液中的溶质可能是NaCl、Na2CO3和HCl。猜想2:废液中的溶质只有NaCl。
猜想3:废液中的溶质是NaCl和HCl。猜想4:废液中的溶质是__________________。
【讨论与交流】小明认为猜想1无需验证就知道是错误的,他的理由是 。
【实验与结论】
(1)小亮同学为验证猜想2,取少量废液装入试管中,然后滴入酚酞溶液,发现酚酞溶液不变色,于是小亮认为猜想2正确。你认为他的结论 (填“正确”或“错误”),理由是 。
(2)小美为验证猜想3,用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=4,她认为猜想3正确。对她的操作方法、测量结果及结论的评价,正确的是 。
A.方法不正确,结果偏小,结论正确
B.方法不正确,结果偏大,结论正确
C.方法正确,结果偏大,结论正确
D.方法正确,结果偏小,结论不正确(3)小丽为验证猜想4成立,可选择的试剂 。
【拓展与应用】若废液中的溶质是NaCl和HCl,根据HCl的性质,无需另加试剂,只要对废液进行操作即可从废液中得到NaCl固体。
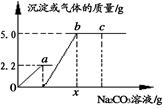
(4)向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液。反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如下图所示。
试回答下列问题:
①oa段表示生成 (填“气体”或“沉淀”)的质量;
②c点对应的溶液中溶质为 ;(2分)
③x值为 。(写出计算过程)(3分)
【猜想与假设】
NaCl和Na2CO3
【讨论与交流】
HCl和Na2CO3在溶液中不能共存
【实验与结论】
(1)错误、溶液中的溶质是NaCl和HCl时,滴加酚酞溶液也不变色。
(2)B;
(3)稀盐酸(或稀硫酸)、氢氧化钙溶液(或氢氧化钡溶液)、氯化钙溶液(或氯化钡溶液)。(合理即可)
【拓展与应用】
蒸发
(4)① 气体;
② NaCl和Na2CO3(或氯化钠和碳酸钠);
③ 106。
题目分析:【猜想与假设】根据题意可知,碳酸钠和盐酸反应,生成氯化钠、水和二氧化碳气体,故反应后的废液的可能组成是:①恰好完全反应,废液中的溶质只有生成的氯化钠;②浓盐酸有剩余,则废液中含有生成的氯化钠和剩余的盐酸;③碳酸钠有剩余,废液中含有剩余的碳酸钠和生成的氯化钠。
【讨论与交流】由于碳酸钠和盐酸能反应,故二者不能同时存在于同一种溶液中,错误。
【实验与结论】
(1)由于酚酞试液只遇碱性溶液变红色,故当溶液中有HCl剩余时,滴加酚酞溶液也不变色,无法证明只有NaCl,错误。
(2)根据猜想3可知,废液中的溶质是NaCl和HCl,故只要能证明其pH<7,即可证明有HCl的存在,故小美的结论是正确的;但由于pH试纸事先被润湿了,故相当于将待测溶液稀释了,稀释后的溶液的酸性会减弱,故pH会变大。故选B
(3)检验碳酸钠的存在,即检验碳酸根离子的存在,故可以把碳酸根离子转化为沉淀或气体来验证,稀盐酸(或稀硫酸)能与碳酸钠反应生成二氧化碳气体,氢氧化钙溶液(或氢氧化钡溶液)、氯化钙溶液(或氯化钡溶液)能与碳酸钠反应生成沉淀。
【拓展与应用】由于盐酸是氯化氢的水溶液,受热时,溶质氯化氢气体会逸出,故直接蒸发即可除去氯化氢。
(4)①向一定质量CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,二者均能与Na2CO3溶液反应,且CaCl2与Na2CO3溶液反应生成的碳酸钙沉淀还能与HCl反应,生成CaCl2、水和二氧化碳,故相当于碳酸钠会先与盐酸反应,当盐酸完全反应,才开始与氯化钙反应,所以oa段表示生成气体的质量。
②b点表示碳酸钠恰好完全反应,此时溶液中只含有生成的NaCl一种溶质;而c点时,碳酸钠已过量,故此时溶液中溶质为生成的NaCl和剩余的Na2CO3。
③根据上面的分析可知,碳酸钠先与盐酸反应,再与氯化钙反应;结合图示可知,碳酸钠与盐酸反应生成二氧化碳气体2.2g,碳酸钠与氯化钙反应生成碳酸钙沉淀5.0g。
设生成2.2g二氧化碳气体所需的Na2CO3的质量为m,生成5.0g碳酸钙沉淀所需Na2CO3的质量为n,则
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
m 2.2g
106:44=m:2.2g
解得,m=5.3g
Na2CO3+ CaCl2=CaCO3↓+2NaCl
106 100
n 5.0g
106:100=n:5.0g
解得,n=5.3g;
所以x=(5.3g+5.3g)÷10% =106g
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等;解答最后一问,一定要注意碳酸钠会先与盐酸反应,再与氯化钙反应。
