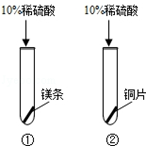
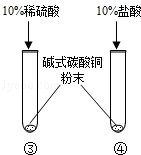
化学小组同学探究“酸的化学性质”,请你参与并完成下列部分实验内容.
| 实验过程 | 实验现象 | 实验结论 |
|
| ①号试管:固体溶解,产生气泡,放热; ②号试管: . | a、金属活动性: 镁 铜(填“>”或“<”) b、涉及到的化学方程式 . |
| (2)
| ③号试管:绿色粉末逐渐溶解,产生气泡,溶液显蓝色. ④号试管:绿色粉末逐渐溶解,产生气泡,溶液显绿色. | Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑ Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑ |
【发现问题】碱式碳酸铜与稀硫酸反应形成的CuSO4溶液显蓝色,而与盐酸反应形成的CuCl2溶液显绿色.
【提出问题】同样都含有Cu2+,为什么③号试管中的CuSO4溶液显蓝色,而④号试管中的CuCl2溶液显绿色.
【猜想与假设】猜想一:若溶液中Cu2+显蓝色,则SO42+对Cu2+显色无影响,而Cl﹣对Cu2+显色有影响;
猜想二:若溶液中Cu2+显绿色,则 ;
猜想三:…
【实验验证】同学们用下列两种不同方案初步验证猜想一,请你补全实验所需试剂:
方案一:取少量③号试管中的溶液于另一支试管中,向其中加入 ,观察到预期实验现象,猜想一正确.
方案二:取少量④号试管中的CuCl2溶液于另一支试管中,向其中加入 ,观察到预期实验现象,猜想一正确.
【评价与反思】同学们在实验探究的过程中,体会到了溶液颜色成因复杂,相关知识还有待进一步学习.
【进行实验】无明显现象;>;Mg+H2SO4═MgSO4+H2↑;
【猜想与假设】SO42﹣对Cu2+显色有影响,而Cl﹣对Cu2+显色无影响;
【实验验证】适量的氯化钡溶液;适量的硝酸银溶液;(其它合理答案也可).
题目分析:【进行实验】因为铜排在氢的后面不能和酸反应,因此无现象;因为镁能够和硫酸反应产生氢气,说明排在氢的前面,故镁>铜;镁和硫酸反应的方程式为:Mg+H2SO4═MgSO4+H2↑;
【猜想与假设】根据猜想一,因此可以提出与之不同的猜想为:SO42﹣对Cu2+显色有影响,而Cl﹣对Cu2+显色无影响;
【实验验证】③号试管中含有的是硫酸根离子,因此可加入氯化钡等溶液使硫酸根离子产生沉淀,结果溶液由蓝色变成绿色,说明SO42+对Cu2+显色无影响,而Cl﹣对Cu2+显色有影响;
④号试管中含有的是氯离子,加入硝酸银溶液后氯离子变成沉淀,结果溶液绿色消失变成蓝色,说明SO42+对Cu2+显色无影响,而Cl﹣对Cu2+显色有影响
点评:本题考查了金属与酸的反应及不同的铜盐显示不同的颜色的原因的探究,关键是熟练掌握金属活动性顺序的意义并能够根据题意设计实验,在设计实验时可以利用排除离子干扰法进行分析.