为进一步研究高锰酸钾的分解产物,某兴趣小组同学查阅资料,并取一定质量的高锰酸钾加热使之完全分解,然后分别进行了以下三个实验。
【实验内容】:
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 固体剩余物中的MnO2对H2O2分解有催化作用 |
| 2 | 取0.2gMnO2加入5mL a (H2O2溶液的质量分数)的H2O2溶液中 | 平稳反应,放出热量,持续产生气体 | MnO2对H2O2分解有催化作用 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | 固体剩余物中无 b |
【实验分析】
(1)完成上表中的填空内容:a 、b ;
(2)实验2的目的是 ;
(3)同学们经过讨论,认为实验1的结论不正确,理由是 ;
【查阅资料】
Ⅰ、KMnO4受热分解时,在某条件下可能发生以下两个反应:
①6KMnO4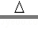 2K2MnO4+K2Mn4O8+4O2↑
2K2MnO4+K2Mn4O8+4O2↑
②KMnO4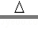 KMnO2+O2↑
KMnO2+O2↑
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
(4)16gKMnO4中氧元素的质量为 ;加热使之完全分解,若完全发生反应①,生成O2的质量为 ;若同时发生反应①②,生成O2的质量范围是 。(保留二位小数。提示:依据质量守恒定律观察)
(1)a:6% b:MnO2
(2)和实验1进行对比,确定MnO2的催化作用
(3)实验3证实固体剩余物中没有二氧化锰,可能是分解后产物中其他物质起催化作用
(4)6.48g 2.16g 2.16g~3.24g
题目分析:(1)(2)实验编号为1和2的两个实验是为了作对比,目的是想说明高锰酸钾分解剩余物中的二氧化锰具有催化作用,因此,除加入的物质不同(一个加高锰酸钾分解剩余物,一个直接加二氧化锰)外,其余的因素都要相同,所以选择加入的过氧化氢溶液也应该是6% 。由于二氧化锰为不溶于水的固体物质,经过滤后发现没有剩余固体,只能说明没有二氧化锰。
(3)实验1的结论认为是固体剩余物中的MnO2对H2O2分解有催化作用,而实验3又证实固体剩余物中没有二氧化锰,故实验1的结论有误。
(4)16gKMnO4中氧元素的质量为16g×64/158=6.48g。若完全发生反应①,生成O2的质量为6.48g的8/24,即2.16g。如果完全按反应②进行,则生成O2的质量为6.48g的2/4,即3.24g,如果同时发生反应①②,生成O2的质量范围是2.16g~3.24g。
