小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验。
| 序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
| ① | 2.0g | 330℃ | 100mL | T1 | |
| ② | 2.0g | CuO 0.5g | 330℃ | 100mL | T2 |
| ③ | 2.0g | MnO2 0.5g | 330℃ | 100mL | T3 |
| ④ | 2.0g | MnO2 g | 380℃ | 100mL | T4 |
若t1 t2(填“>”、“=”、“<”),说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的___________和________________不变。
你认为小雨设计实验③和实验②对比的目的是 。
实验④中MnO2的质量为 g,若t3>t4,则化学反应快慢与温度的关系是 。
(4)写出实验④所涉及的化学方程式 。
(1)> 质量 化学性质
(2)探究氧化铜是否比二氧化锰的催化效果更好
(3)0.5 ;温度越高,反应速率越快;
(4)2KClO3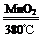 2KCl+3O2↑
2KCl+3O2↑
题目分析:(1) 氧化铜能加快氯酸钾的分解速率,那么收集等体积的氧气所需时间更少,即
t1>t2 ;判断一种物质是否是某反应的催化剂,要看它是否具备催化剂的特征,即“一变二不变”: 能否改变反应的速率;反应前后本身的质量,是否改变;本身的化学性质是否改变。
(2)实验③和实验②分别选用了氧化铜和二氧化锰,催化剂的种类不同,即目的是探究氧化铜是否比二氧化锰的催化效果好。
(3)比较化学反应快慢与温度的关系,应采用控制变量法,即催化剂的质量相同,为0.5g ,t3>t4,则温度低的反应速率更慢,即温度越高,反应速率越快;
(4)实验④是用氯酸钾制取氧气,生成的是氯化钾和氧气,反应的化学方程式为2KClO3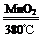 2KCl+3O2↑
2KCl+3O2↑
