某兴趣小组同学阅读课外资料得知:很多因素都能影响过氧化氢分解速度。于是,
同学们探究影响过氧化氢分解速度的某种因素。
【实验过程】实验数据记录如下:
| 过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 测量数据 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9 mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16 mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31 mL |
【实验分析】
(1)过氧化氢分解的化学方程式为 。
(2)表格中的“测量数据”的指的是:相同时间内 _。
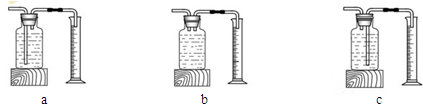
(3)本实验中,测量O2体积的装置是 (填编号)。
【实验结论】
在相同条件下 。
【交流评价】
(1)甲同学提出在上述实验中测量 同样能得出相同的结论。
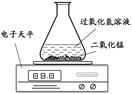
(2)乙同学提出用下图装置进行实验,通过比较 也能达到实验目的。
【实验反思】
除了上述因素会影响过氧化氢分解速度外, _(写一种)也会影响过氧化氢分解速度,你的实验方案是 。
【实验分析】
(1)2H2O2 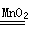 2H2O + O2↑ (2)相同时间内收集氧气的体积
2H2O + O2↑ (2)相同时间内收集氧气的体积
(3)C
【实验结论】
双氧水浓度越大,产生氧气速度越快
【交流评价】
(1)收集等体积氧气所需要的时间
(2)电子天平的读数不再发生变化时,所需要的时间
【实验反思】
催化剂的种类(温度等)
分别取等质量等浓度的过氧化氢溶液,依次加入等量、不同种类的催化剂,记录收集等体积氧气所需要的时间
题目分析:过氧化氢分解生成水和氧气:2H2O2 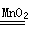 2H2O + O2↑ ;探究影响过氧化氢分解速度的某种因素要通过比较相同时间内收集氧气的体积,收集到的氧气的量越大,说明反应速率越快;测量O2体积可通过测量排出的水的体积来判断,故选C装置;通过该实验可以发现双氧水浓度越大,产生氧气速度越快;探究影响过氧化氢分解速度的某种因素要通过比较相同时间内收集氧气的体积,或收集相同体积的氧气所需时间的长短;过氧化氢分解产生的氧气会逸散到空气中,该装置可通过电子天平的读数不再发生变化时,所需要的时间,时间越短,说明反应速率越快;温度和催化剂也会影响过氧化氢的分解速率,但要采用控制变量法,如分别取等质量等浓度的过氧化氢溶液,依次加入等量、不同种类的催化剂,记录收集等体积氧气所需要的时间。
2H2O + O2↑ ;探究影响过氧化氢分解速度的某种因素要通过比较相同时间内收集氧气的体积,收集到的氧气的量越大,说明反应速率越快;测量O2体积可通过测量排出的水的体积来判断,故选C装置;通过该实验可以发现双氧水浓度越大,产生氧气速度越快;探究影响过氧化氢分解速度的某种因素要通过比较相同时间内收集氧气的体积,或收集相同体积的氧气所需时间的长短;过氧化氢分解产生的氧气会逸散到空气中,该装置可通过电子天平的读数不再发生变化时,所需要的时间,时间越短,说明反应速率越快;温度和催化剂也会影响过氧化氢的分解速率,但要采用控制变量法,如分别取等质量等浓度的过氧化氢溶液,依次加入等量、不同种类的催化剂,记录收集等体积氧气所需要的时间。