现有Cu和CuO的固体混合物20g,为了分析混合物中Cu和CuO的含量,小
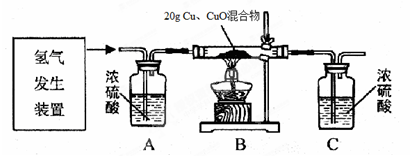
冰同学利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究。
得到如下数据:(假定每步均完全反应或吸收)
| 装置 | B | C |
| 反应前质量 | 85.3g | 284.2g |
| 反应后质量 | 82.1g | 287.8g |
根据实验设计及有关数据进行分析与计算:
(1)生成水的质量是 g。
(2)混合物中CuO的质量分数是为多少?(写出计算过程)
(3)该实验还可测定组成水的各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为_______________________________________(不用化简);若玻璃管中的氧化铜没有完全反应,则求得水中氢、氧元素的质量比会__________(选填“偏大”、“偏小” 或“不变”)。
(1)(1分)3.6
(2)(4分)(设答共1分,其它共3分)
解:设混合物中CuO的质量为X
H2+CuO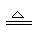 Cu+H2O
Cu+H2O
80 18
X 3.6g
80:18= X:3.6g
解得 X="16" g
混合物中氧化铀的质量分数为了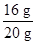 ×100%=80%
×100%=80%
答:混合物中氧化铜的质量分数是80%
(3)(2分)H:O=[(287.8—284.2)—(85.3-82.1)]:(85.3-82.1)
题目分析:(1)在图示装置中,A的作用是除去氢气中的水蒸气;B的作用是反应装置;C的作用是吸收生成的水。所以生成水的质量实际上就是C装置的质量变化值。即287.8g—284.2g=3.6g
(2)已知:水的质量 未知:氧化铜在混合物中的质量分数。 解题思路:可根据水和氧化铜在反应中的质量关系求出氧化铜的质量,再求出其质量分数。具体解题过程见答案
(3)装置B内的物质在反应前为氧化铜,反应后为铜。所以反应前后的质量差值即为氧元素的质量。即(85.3-82.1)g。水中氢元素的质量为:[(287.8—284.2)—(85.3-82.1)]g。
