四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2Na2S4+O2+2H2O=8S↓+4NaOH
【查阅资料】①Na2S4受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢。
②硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应。
③NaOH溶液可吸收硫化氢和二氧化碳。
【实验过程】
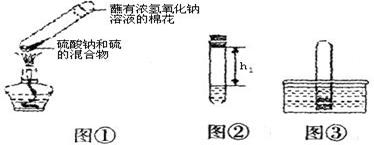
①取0.5g碳酸钠、0.2g硫粉混合后置于试管中,加入(如图①所示,夹持装置已略去),制得Na2S4,反应为:4Na2CO3+12S+X 2Na2S4+2Na2S2O3+4CO2,X的化学式为 ;
2Na2S4+2Na2S2O3+4CO2,X的化学式为 ;
②冷却后,取下棉花,放置一段时间,再向该试管中加入10mL水,迅速塞紧橡胶塞,充分振荡。测量液面至橡胶塞下沿的距离,记录数据h1(如图②所示);
③将该试管插入水中(如图③所示),拔下橡胶塞,观察到 ,塞紧橡胶塞。将试管取出,倒转过来,测量液面至橡胶塞下沿的距离h2,记录数据h2。理论上h2:h1= ;
④按照①~③再重复实验2次。3次实验数据如下表所示。
| 第1次 | 第2次 | 第3次 | |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
【解释与结论】根据第1次实验数据,计算空气中氧气的体积分数为 %(结果精确到0.1%);
【反思与评价】实验过程①中浓NaOH溶液的作用是 ;若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,测定结果 (填“偏大”、“偏小”或“无影响”),理由是: 。(2分)
实验过程①O2;③试管内液面上升; 4:5(79:100)
解释与结论:20.9%
反思与评价:吸收二氧化碳和硫化氢气体;偏小;氧气没有完全消耗
题目分析:①根据质量守恒定律的微观解释,在化学反应前后,原子的种类、数目、质量均保持不变,可以推知X的化学式为O2, ③在图1中,碳酸钠、硫粉、氧气发生反应生成了Na2S4,冷却后,取下棉花,放置一段时间,外面的进入试管内,此时再向该试管中加入10mL水,迅速塞紧橡胶塞,充分振荡,发生了反应:2Na2S4+O2+2H2O=8S↓+4NaOH,即充分地将试管内空气中的氧气完全消耗了,使得试管内的气体减少了将近1/5(即空气中氧气体积分数),压强也减少,这时将该试管插入水中(如图③所示),拔下橡胶塞,自然观察到:试管内液面上升,由于消耗了1/5的氧气,所以水面上升1/5,只剩下4/5, 所以h2:h1=4:5
解释与结论:根据第1次实验数据,h1=11.0,h2=8.7,所以消耗氧气的体积=11.0-8.7=2.3,空气中氧气的体积分数=2.3/11.0×100%=20.9%
反思与评价:由于反应中会生成二氧化碳,且Na2S4受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢,所以浓NaOH溶液的作用是吸收二氧化碳和硫化氢气体,若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,温度没有冷却下来,在受热的情况下,生成的Na2S4会与空气中的水蒸气反应,使得Na2S4的量大大减少,这样就不能完全消耗的氧气
