(10分)将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习
小组对蓝色固体的成分进行了如下探究。请完成下列各题:
Ⅰ.猜想与假设:
猜想一:固体为CuCO3,理由:___________________(用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈______(填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
Ⅱ.资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水;无水硫酸铜是白色固体,遇水会变成蓝色的硫酸铜晶体。
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
Ⅲ.设计与实验:
㈠固体的获取:
⑴将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体。
⑵判断固体已洗净的方法及现象_______________________________________。
㈡用下图所示装置,定性探究固体的成分。
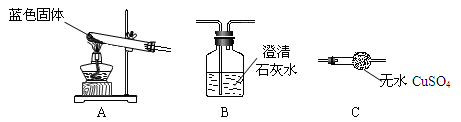
⑶小组同学将装置按 A、______、______(填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的,实验中:A中的现象为_________________________,C中的现象为______________________。
结论:固体为Cu(OH)2和CuCO3的混合物。
㈢固体成分定量测定:
已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为
200℃~220℃。设固体的组成为aCu(OH)2•bCuCO3。小组同学
用热分析仪对固体进行热分解,获得相关数据,绘成固体质量
变化与分解温度的关系如下图,请根据图示回答下列问题:
⑷写出AB、CD段发生反应的化学方程式:
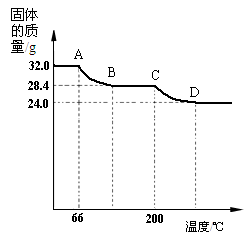
AB段:___________________________________;
CD段:___________________________________;
⑸通过计算可得:a:b=________。(请写出计算过程)
Ⅰ.猜想与假设
Na2CO3 +CuSO4=CuCO3↓+Na2SO4(1分) 碱(1分)
Ⅲ.设计与实验
⑵取最后洗涤液少量,滴加适量的稀盐酸(硝酸、硫酸),无气泡产生;或滴加BaCl2 [或Ba(OH)2、Ba(NO3)2]或CaCl2[或Ca(OH)2、Ca(NO3)2]溶液,无沉淀产生。(其它合理答案均给分)(1分)
⑶C B(共1分) 蓝色固体逐渐变成黑色(1分) 白色固体变蓝(1分)
⑷Cu(OH)2△CuO + H2O (1分) CuCO3△CuO + CO2 ↑ (1分)
⑸2 : 1 (2分)
题目分析:Ⅰ.猜想与假设:依据质量守恒定律和物质的性质可得,Na2CO3 +CuSO4=CuCO3↓+Na2SO4;因为, Na2CO3溶液呈碱性,故溶液中含有氢氧根;Ⅲ.设计与实验:⑵因为是碳酸钠和硫酸铜的反应,二者可能恰好反应,或者剩余二者之一,依据性质检测是否洗净即可:检测碳酸根或者硫酸根或者铜离子;⑶因为检测二氧化碳要经过澄清石灰水,会干扰生成水的检测,故,应先通过C变蓝检测有水生成,再通过B看变浑浊检测有二氧化碳的生成;氢氧化铜蓝色,氧化铜黑色,蓝色固体逐渐变成黑色;硫酸铜白色粉末,与水反应生成蓝色晶体,故白色固体变蓝色;(4)AB和CD段固体质量减少,故反应方程式为:Cu(OH)2△CuO + H2O,CuCO3△CuO + CO2 ↑;
(5)由题意可知AB段生成水的质量为32.0g—28.4g = 3.6g,
CD段生成二氧化碳的质量为28.4g—24.0g = 4.4g
则生成水和二氧化碳的分子个数比为3.6g/18:4.4g/44=2:1
再结合化学方程式的系数比,可知a:b=2:1
