(6 分)某化学兴趣小组在实验室发现了
一瓶标签受到腐蚀(如图所示液,他们对此产生了兴趣。
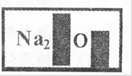
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种。为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是______。
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是_______。
为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验。
(3) 该瓶无色溶液是_______。生成白色沉淀过程的化学方程式是_______。
(4)小强认为上述设计实验还可简化,仍能达到目的。小强的实验操作是______。经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐。简述实验操作和现象____________。
( 1)NaCl (2)这二者的化学式中Na元素的右下角不会有2
(3)Na2CO3 ;BaCl2 + Na2CO3 = BaCO3↓+2NaCl ;(4)取少量无色溶液样品于试管中,慢慢滴加稀盐酸;
在玻璃片上放一小片pH 试纸,将样品液滴到试纸上,把试纸显示的颜色与标准比色卡比较,测得溶液pH 大于7。(或取少量无色溶液样品于试管中,滴加几滴无色酚酞,观察到溶液变红等。)
题目分析:根据物质的化学式可推知(1)小明根据标签上的组成元素认为一定不可能是氯化钠,(2)小英提出,碳酸氢钠、硝酸钠也不可能,她的依据是这二者的化学式中Na元素的右下角不会有2;(3) 该瓶无色溶液是碳酸钠,生成白色沉淀过程的化学方程式是BaCl2 + Na2CO3 = BaCO3↓+2NaCl ;(4)根据上面的排除,可知是硫酸钠和碳酸钠的鉴别,故小强的实验操作是取少量无色溶液样品于试管中,慢慢滴加稀盐酸。还可以根据溶液的酸碱性进行判断,其操作为:取少量无色溶液样品于试管中,滴加几滴无色酚酞,观察到溶液变红等。
