(14分)将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组欲对蓝色固体的成分进行探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈 (填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水;
②Cu(OH)2、CuCO3受热易分解,化学反应方程式分别为:
Cu(OH)2==CuO+H2O CuCO3==CuO+CO2
③无水CuSO4遇水变蓝色。
(三)设计与实验:
Ⅰ.固体的获取:
将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体。
Ⅱ.用下图所示装置,定性探究固体的成分。
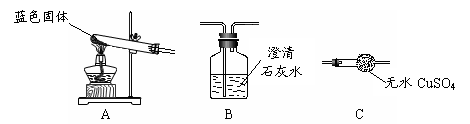
(1)若用装置A、B组合进行实验,B中无现象,则猜想 正确;
(2)若用装置A、C组合进行实验,C中无现象,则猜想 正确;
(3)小组同学将装置按 A、 、 (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的;实验中: C中的现象 。
结论:固体为Cu(OH)2和CuCO3的混合物。
Ⅲ.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量变化与分解温度的关系如下图,请根据图示回答下列问题:
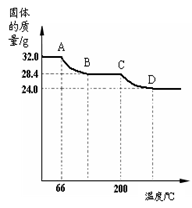
(4)根据图示从A点到达B点时的固体质量差,求被分解的氢氧化铜的质量(写出计算过程)。
(5)通过计算可得32.0g固中C元素和H元素的质量比= 。
(6)若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式: 。
(一)Na2CO3+CuSO4="===" CuCO3↓+ Na2SO4 碱
(三)Ⅱ⑴猜想二 ⑵猜想一
⑶ C、B 无水硫酸铜变蓝色
⑷19.6g ⑸ 3:1 (6)4CuO△2Cu2O+O2↑
题目分析:(1)根据复分解反应发生的条件,相互交换成分,Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体,发生的化学方程式为:Na2CO3+CuSO4="===" CuCO3↓+ Na2SO4
(2) Na2CO3溶液呈碱性
(三)设计与实验:
(1) 若用装置A、B组合进行实验,B中无现象,说明无二氧化碳生成,则猜想二成立
(2)若用装置A、C组合进行实验,C中无现象,说明无水生成,则猜想一成立
(3)要同时验证生成物中既有二氧化碳生成,又有水生成,应该先验证水,再验证二氧化碳,所以装置应按A、C、B的顺序组合进行实验,这样即可验证出猜想三是正确的,此时C中现象无水硫酸铜变蓝色,B中的澄清石灰水变浑浊,可得出结论:固体为Cu(OH)2和CuCO3的混合物
(4)根据图示从A点到达B点,温度处在200℃以内,此时发生的反应是Cu(OH)2的分解,所以固体质量差是水的质量=32g-28.4g=3.6g,可设氢氧化铜的质量为x
Cu(OH)2==CuO+H2O
98 18
x 3.6g
98:18=x:3.6g ∴x=19.6g
(5)根据上面的计算Cu(OH)2的质量是19.6g,故氢元素的质量=19.6g×2/98×100%=0.4g,CuCO3的的质量=32g-19.6g=12.4g,故碳元素的质量=12.4g×12/124×100%=1.2g,所以32.0g固中C元素和H元素的质量比=1.2g:0.4g=3:1
(6)加热到220℃,此时的Cu(OH)2和CuCO3都已全部分解,得到纯净的CuO24g,若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,根据质量守恒定律分析,减少的质量只可能是氧气,故此过程中可能发生反应的化学方程式:4CuO△2Cu2O+O2↑
