(11分)某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
| 实验装置 | 实验步骤及操作 | 实验现象 |
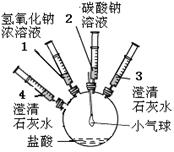 | ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
| ②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
| ③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
| ④ | 无明显现象 | |
| ⑤将注射器4中的溶液推入瓶中 |
(2)步骤①、②可得出碳酸钠具有 的性质;
(3)步骤④的操作是 ,其目的是 ;
(4)步骤⑤中发生反应的化学方程式 ;
(5)步骤③④⑤可得出碳酸钠具有 的性质;
(二)上述实验结束后,实验小组的同学又对瓶内溶液的成分十分好奇,进行了探究:
(1)【提出猜想】通过分析,一致认为瓶内溶液的溶质中一定含有 ,可能含有氢氧化钙或 。
(2)【实验验证】设计实验方案确定溶液中溶质的组成.
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量溶液于A、B两支试管中,A中 加入CaCl2溶液,B中加入Na2CO3溶液 | A中产生白色沉淀,B中没有沉淀 | 瓶内溶液中溶质的成分为 |
(3)【反思与交流】根据所学化学知识,除了以上方案外,下列哪些物质可以代替试管B中加入的Na2CO3溶液完成该实验? (填序号)
a.K2CO3 b.BaCO3 c.CO2 d.无色酚酞 e. CuSO4
(一)(1) 碳酸钠与稀盐酸反应生成CO2,内部压强大于大气压
(2) 与盐酸反应生成CO2
(3)将注射器4稍稍向外拉 证明CO2完全被吸收
(4) Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(5)与含Ca2+的溶液反应生成白色沉淀
(二)(1)【提出猜想】 NaOH和NaCl Na2CO3
(2)【实验验证】
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量溶液于A、B两支试管中,A中 加入CaCl2溶液,B中加入Na2CO3溶液 | A中产生白色沉淀,B中没有沉淀 | 瓶内溶液中溶质的成分为 NaOH、NaCl 和 Na2CO3 |
题目分析:(1)步骤①中气球变瘪的原因:将注射器2中的溶液推入盛有稀盐酸的瓶中,碳酸钠与稀盐酸反应生成CO2,内部压强大于大气压,把瓶中的气球压扁
(2)由于步骤①发生反应,且生成了二氧化碳,所以②将注射器3稍稍向外拉,其实就是将瓶中的二氧化碳吸入注射器,这样澄清石灰水变浑浊,从而得出碳酸钠具有与盐酸反应生成CO2的性质
(3)③将注射器1中的NaOH溶液推入瓶中,NaOH溶液能与二氧化碳发生反应:2NaOH + CO2 ="=" Na2CO3 + H2O,这样二氧化碳被消耗,瓶内压强减小,气球鼓起,此时步骤④的操作是:将注射器4稍稍向外拉,目的是:证明CO2完全被吸收
(4)步骤⑤将注射器4中的澄清石灰水推入瓶中,与步骤④生成的Na2CO3反应,所以步骤⑤中发生反应的化学方程式:Na2CO3+ =CaCO3↓+2NaOH
(5)步骤③④⑤可得出碳酸钠具有与含Ca2+的溶液反应生成白色沉淀的性质
二(1) 【提出猜想】因为瓶内发生了这几个反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,根据反应后溶液中的溶质成分:除了考虑生成物一定有,反应物可能过量,所以瓶内溶液的溶质中一定含有:NaOH和NaCl,可能含有氢氧化钙或Na2CO3
(2)【实验验证】因为加入CaCl2溶液产生白色沉淀,说明含有Na2CO3,所以瓶内溶液中溶质的成分为NaOH、NaCl 和Na2CO32、Na2CO3的化学性质
