铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
图:______________正极反应:___________________,负极反应:__________________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤____________________________________。
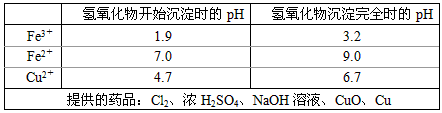
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式
________________________、________________________。劣质不锈钢腐蚀的实验现象________________________________________。
(1)2Fe3++Cu = 2Fe2++Cu2+
(2)装置图: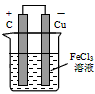 ;正极反应:Fe3++e- = Fe2+(或2Fe3++2e-==2Fe2+);负极反应:
;正极反应:Fe3++e- = Fe2+(或2Fe3++2e-==2Fe2+);负极反应:
Cu-2e-=Cu2+
(3)①通入足量氯气将Fe2+氧化成Fe3+;
②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4==CuSO4+H2O;CuSO4+Fe==FeSO4+Cu;不锈钢表面有紫红色物质生成
