某班级同学对实验室制取二氧化碳的若干问题进行如下探究
实验一:实验室制取二氧化碳的原料的选择,实验内容和现象记录如下
| 实验 步骤 |
|
|
|
| 现象 | 剧烈反应,产生大量气泡,反应迅速停止 | 产生气泡,速率迅速减慢,反应几乎停止. | 产生气泡,反应持续时间较长 |
| 分析 | 反应速率过快,气体不便收集 | 无法持续产生CO2 | ______ |
| 结论 | 实验室制取二氧化碳的原料是______. | ||
①如图1所示是制取和收集二氧化碳的装置,其中气体发生装置的适用范围是______,集气瓶中导管应处的位置是______(填“a”或“b”).
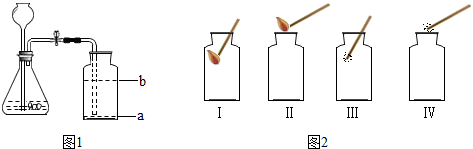
②图二中,能够检验二氧化碳是否收集满的方法是______.
③该发生装置不具有启普发生装置的原理,理由是______.
Ⅰ.不能控制反应的发生
Ⅱ.不能控制反应的停止
Ⅲ.不能控制反应的发生和停止
实验三:计算实验室使用的大理石中碳酸钙的质量分数用足量的盐酸与12g块状大理石反应,得到0.1mol二氧化碳(杂质不参加反应).
④求块状大理石中碳酸钙的质量.(请根据化学方程式计算)
⑤该大理石中碳酸钙的质量分数是______(精确到0.1%).
(1)由现象:产生气泡,反应持续时间较长可知,本实验速率适中(持续产生二氧化碳),便于收集气体,故答案为:速率适中(持续产生二氧化碳),便于收集气体
(2)实验三速率适中(持续产生二氧化碳),便于收集气体,适合于二氧化碳的实验室制法.故答案为:块状大理石和稀盐酸
(3)大理石和稀盐酸反应在常温下就能进行,故答案为:常温、固液反应;
(4)导管要伸到集气瓶的底部,故答案为:a
(5)验满方法是燃着的木条平放在集气瓶口,故答案为:Ⅱ
(6)该发生装置不具有启普发生装置的原理,理由是:不能控制反应的停止,故答案为:Ⅱ
⑤设12g大理石中碳酸钙的质量为x,二氧化碳的质量=0.1mol×44g/mol=4.4g
0.1molCaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
=100 x
x=10g44 4.4g
×100%=83.3%10g 12g
故答案为:83.3%