问题
问答题
实验室用足量的稀盐酸跟方解石(较纯的CaCO3晶体)反应制得二氧化碳.反应的化学方程式是
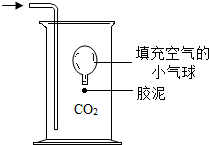
______.如右图所示的装置,容器的容积为11.2L(CO2密度按1.97g/L计)至少需要方解石______g.为什么实际需要的方解石超过理论计算量?______.在通常状况下,填充有空气的小气球在空气中会下沉.但在充满二氧化碳的容器中会悬浮.这个实验现象说明了二氧化碳______.
答案
碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,化学方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O;在化学方程式中已知二氧化碳的质量为11.2L×1.97g/L,=22g,可求出碳酸钙质量;由题中信息方解石是较纯的碳酸钙,说明方解石中有杂质,且二氧化碳能溶于水,故实际需要的方解石超过理论计算量;由于二氧化碳的密度比空气密度大,充满空气的气球在二氧化碳中受到的浮力大于重力,故会上浮.
设需方解石质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
X 22g
=100 x
x=50g44 22g
故答案为:
CaCO3+2HCl═CaCl2+CO2↑+H2O(1分);50g(2分);方解石含有杂质,CO2能溶于水(2分);密度大于空气(1分).
