(9分)由铜片、锌片和200 mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,当铜片上放出3.36 L(标准状况)气体时,硫酸恰好全部作用完。试计算:
(1)产生这些气体消耗了多少克锌?
(2)有多少个电子通过了导线?
(3)200 mL稀H2SO4的物质的量浓度是多少?
(1)9.75 g
(2)1.806×1023个
(3)0.75 mol·L-1
(1)Zn+2H+====Zn2++H2↑
6.5 g 22.4 L
m(Zn) 3.36 L
m(Zn)="9.75" g
(2)负极:Zn-2e-====Zn2+
正极:2H++2e- ="=== " H2↑
2 mol 22.4 L
m(e-) 3.36 L
n(e-)="0.3" mol
通过导线的电子数为:0.3 mol×6.02×10-23 mol-1=1.806×1023个
(3)Cu片上:2H++2e-====H2↑
2 mol 22.4
n(H+) 3.36 L
n(H+)="0.3" mol则n(H2SO4)="0.15" mol,c(H2SO4)=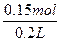 ="0.75" mol·L-1。
="0.75" mol·L-1。

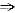 =0有两个不等的实数根,其中R、r分别为⊙O1、⊙O2的半径,d为此两圆的圆心距;
=0有两个不等的实数根,其中R、r分别为⊙O1、⊙O2的半径,d为此两圆的圆心距;