某课外活动小组按右图所示装置制取二氧化碳,并检验二氧化碳的性质:若用装置B来证明二氧化碳与水反应生成碳酸,B中除有少量水外,还应加入的试剂是 ,当①、②导管口连接时,B中看到的实验现象是: ,
其反应的化学方程式为: 。

当导管断开一段时间后,看到B中的现象是 ,
其反应的化学方程式为: .
为测定当地石灰石含碳酸钙的质量分数,该课外活动小组取来一些矿石,并取稀盐酸200g,将其平均分成4份,进行实验,其结果如下:
| 实验 | 第1份 | 第2份 | 第3份 | 第4份 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
(1)哪几项反应中盐酸有剩余 。
(2)上表中m的数值是 。
(3)试计算这种石灰石中碳酸钙的质量分数。
石蕊溶液 石蕊溶液由紫色变红色 CO2 + H2O ="==" H2 CO3
红色逐渐消失又变紫色 H2 CO3 ="==" H2 O + CO2↑
(1)等一、二份 (2)4.4
注:以上每空各1分,合7分
(3)解:设 生成1.54g CO2 需要碳酸钙质量为x(0.5分)

答:略(0.5分)(其他解法符合题意也给分)
(1)二氧化碳能与水反应生成碳酸,酸性物质能使紫色石蕊变红,所以反应的化学方程式为:CO2+H2O=H2CO3;
(2)二氧化碳能与水反应生成碳酸,碳酸能使紫色的石蕊溶液变红.碳酸不稳定,受热易分解,因此红色溶液又会变成紫色 所以反应的化学方程式为H2 CO3 ="==" H2 O + CO2↑
(1)第3次实验50g稀盐酸量不足石灰石没完全反应,第4次实验石灰石增加到20g时,50g稀盐酸依然量不足而石灰石没有完全反应;
故答案为:1、2;
(2)当石灰石质量为15g时,就因50g稀盐酸量不足而石灰石没完全反应,所以,石灰石增加到20g时,50g稀盐酸依然量不足,所以此时产生二氧化碳的质量仍然为4.4g,也就是m值为4.4g;
故答案为:4.4g;
(3)解:设 生成1.54g CO2 需要碳酸钙质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
5g×x 1.54g
 =
=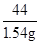
解之得:x=70%
答:该这种石灰石矿中碳酸钙的质量分数为70%.
