(15分)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃,101kPa时,16.0g N2H4在氧气中完全燃烧生成氮气,放出热量312kJ,N2H4完全燃烧反应的热化学方程式是 。
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是: 。电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(2)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是500mL足量的饱和氯化钠溶液,当两极 * * 生1.12L气体时,溶液的pH为 ,
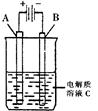
则肼-空气燃料电池理论上消耗的空气 L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)
(3)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(4)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+) 0.1
mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(5)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2
mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+
离子浓度由大到小的顺序为 。
(15分,除标注外每空2分)
(1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624 kJ/mol
N2H4+ 4OH- — 4e-=4H2O +N2↑ 减小(1分)
(2) 13 1.4
(3)N2H4+H2O  N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H2+6+OH-
N2H2+6+OH-
(4)大于
(5)c(N2H+5)>c(Cl-)>c(OH-)>c(H+)
