(共14分)Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 (填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
Ⅱ.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图所示实验装置则可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁。
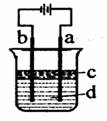
(1)a电极材料为 ,该电极反应式
(2)若白色沉淀在电极上生成,则电解液d是 ,若白色沉淀在两极之间的溶液中生成,则电解液d是________(填字母代号)
A、纯水 B、NaCl溶液 C、NaOH溶液 D、CuCl2溶液
(3)液体c为苯,其作用是
(4)若在两极之间的溶液中能短时间内看到白色沉淀,可以采取的措施是________________。
A、改用稀硫酸做电解液 B、适当增大电源电压 C、适当降低电解液温度
Ⅰ.②⑤
Ⅱ.(1)Fe Fe -2e— = Fe2+
(2)C;B
(3)隔绝空气,防止白色沉淀被氧化
(4)B
I 只要能引起标准溶液体积偏小的操作就会导致实验结果偏低。
①碱式滴定管用蒸馏水洗净后导致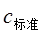 偏小,致使
偏小,致使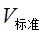 偏大,待测浓度偏大。
偏大,待测浓度偏大。
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗,导致待测液用量偏小,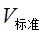 偏小,待测浓度偏小
偏小,待测浓度偏小
③锥形瓶是否用蒸馏水洗涤并不影响酸碱的用量,对结果没有影响
④气泡占用了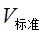 ,使其偏大,待测浓度偏大
,使其偏大,待测浓度偏大
⑤终点读数时俯视,其他读数方法正确,导致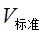 偏小,待测浓度偏小
偏小,待测浓度偏小
II Fe(OH)2的关键是隔绝空气,防止氧气的氧化;
(1)为了得到Fe2+,铁必须做阳极:Fe—2e—= Fe2+,即电源正极a必须连接铁
(2)首先排除水,它导电性差,一般不做电解质液;再排除CuCl2溶液,电解时,不能产生OH—;当电解液为NaCl时,阴极上氢离子放电,促进水的电离产生产OH—,与阳极上产生的H+可在电极之间相遇产生沉淀;不然还可以使用NaOH溶液,直接在阳极就可以产生沉淀。
(3)上层液体直到隔绝空气的作用,可用一些密度小于水的有机液体,例如苯等;
(4)若在两极之间的溶液中能短时间内看到白色沉淀,则必须增大电解的速率,比如适当增大电源电压、适当升高电解液温度等,但加稀硫酸绝对不可,否则不可能得到碱性的沉淀;