图—1是实验室制取二氧化碳气体的装置图,请回答下列问题:
①写出仪器A的名称 (1) 。
②检查此装置的气密性时,关闭弹簧夹,从仪器A处注入适量的 (2) 形成液封后,若看到仪器A内 (3) ,则表明装置气密性良好。
③为了制得较多的二氧化碳,可对图—1中所示仪器进行改变,请写出你的方法 (4) 。
④同学们在图—1装置不漏气、操作正确、加入药品足量且质量相等的情况下同时进行了实验,
以下是他们的的实验记录:
| 甲 | 乙 | |
| 现象 | 产生气泡缓慢并逐渐停止。 | 反应剧烈,产生气泡很快。 |
请分析产生上述两种现象的可能的原因:
甲同学: (5) ;乙同学: (6) 。
经过以上实验分析,你认为影响反应速度快慢的因素有 (7) 等。
丙同学重新选择药品,进行实验并观察到产生气泡速度适中。但是将产生气体通入足量的澄清石灰水,澄清石灰水不浑浊。请你分析可能的原因: (8) ;
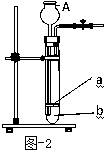
⑤同学们在图—1装置中添加了多孔隔板,得到了图—2所示装置。添加多孔隔板的作用是 (9)。 实验过程中,将固体药品放在 (10) (填a或b)处,从A处加入一定量液体,从而产生二氧化碳。若关闭弹簧夹,继续反应产生的二氧化碳会使容器内 (11) ,将液体压回仪器A中,使固体与液体 (12) ,反应即自行停止。
⑥请写出证明二氧化碳气体已经集满的方法 (13) 。
⑦同学们确定了合适的药品进行实验,成功收集到0.01mol二氧化碳气体。实验中消耗了10克盐酸(假设溶质全部反应完),请问该盐酸溶液溶质的质量分数?(根据化学方程式列式计算)
①(1)长颈漏斗(错别字扣分)
②(2)水 (3)液面不下降
③(4)将试管换成锥形瓶或广口瓶或用启普发生器(答案合理即可)
④(5)甲使用了硫酸 (6)乙使用了碳酸钙粉末(碳酸钠也对,答案合理即可)
(7)反应物种类、反应物的接触面积 (本小题2分,漏写一个扣1分)
(8)丙同学使用了浓盐酸
⑤(9)放置块状固体 (10)a (11)压强增大 (12)分离
⑥(13)点燃的木条放在集气瓶口(方法、位置必须都正确)
⑦ 设:消耗了x mol HCl
CaCO3+2HCl CaCl2 + CO2↑+ H2O (1分)
CaCl2 + CO2↑+ H2O (1分)
2 1
x 0.01
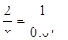 (1分)
(1分)
x =0.02mol (1分)
HCl的质量:0.02 mol×36.5 g/mol="0.73" g (1分)
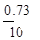 ×100%=7.3% (1分)
×100%=7.3% (1分)
答:消耗的盐酸溶质质量分数为7.3%
本题考查的是二氧化碳的实验室制法,气体制取装置的气密性检查,影响化学反应速率的因素探究,二氧化碳的检验和验满以及根据化学反应方程式的计算。
①根据实验室常见仪器名称及用途,结合图示可知仪器A的名称为:长颈漏斗;
②根据检查装置的气密性的方法可知,在仪器A处注入适量的水形成液封后,若看到仪器A内液面不下降,则表明装置气密性良好;
③根据题意制得较多的二氧化碳,可更换试管为较大容器,如:将试管换成锥形瓶或广口瓶或用启普发生器;
④根据实验室制取二氧化碳的反应原理、方法和操作注意事项,分析产生两种现象的可能的原因是:甲同学使用了硫酸,因为硫酸与碳酸钙反应生成的硫酸钙会覆盖在碳酸钙表面,阻止了碳酸钙与硫酸的进一步反应,所以反应会停止;乙同学使用碳酸钙粉末(或碳酸钠),因为反应物的接触面积越大反应速度就会越快,其次反应物种类不同反应速度也不同。
因此影响反应速度快慢的因素有:反应物的接触面积、反应物的种类等;
根据浓盐酸具有挥发性,收集到的二氧化碳不纯,含有氯化氢气体,澄清石灰水不浑浊;
⑤根据图-2装置能将固体液体完全分离,可知添加多孔隔板的作用是放置块状固体;实验过程中,将固体药品放在 a 处,从A处加入一定量液体,从而产生二氧化碳;若关闭弹簧夹,继续反应产生的二氧化碳会使容器内压强增大,将液体压回仪器A中,使固体与液体分离,反应即自行停止;
⑥根据二氧化碳气体集满的方法:用燃着的木条放在瓶口,如果木条熄灭,则说明瓶内已收集满二氧化碳;
⑦根据二氧化碳气体的量依据化学方程式计算出消耗盐酸的量,具体过程参照答案。
